Đề kiểm tra 1 tiết chương I: Oxit-Axit -Đề 1
a) \(Mg+H_2SO_4\xrightarrow[]{}MgSO_4+H_2\\ MgO+H_2SO_4\xrightarrow[]{}MgSO_4+H_2O\)
b) \(n_{H_2SO_4}=\dfrac{200.24,5}{100.98}=0,5\left(mol\right)\)
Gọi x, y là số mol Mg, MgO
⇒ \(n_{H_2SO_4}=x+y=0,5\left(mol\right)\)
Ta có hpt: \(\left\{{}\begin{matrix}24x+40y=16,8\\x+y=0,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,3\end{matrix}\right.\)
\(n_{H_2}=n_{Mg}=0,2\left(mol\right)\)
Theo BTKL: \(m_{hh}+m_{ddH_2SO_4}=m_{ddsau}+m_{H_2}\)
⇒ \(m_{ddsau}=16,8+200-0,2.2=216,4\left(g\right)\)
\(m_{MgSO_4}=120.\left(0,2+0,3\right)=60\left(g\right)\)
\(C\%_{MgSO_4}=\dfrac{60}{216,4}.100=27,73\%\)
Đúng 1
Bình luận (0)
Cho hỗn hợp gồm bạc và kẽm tác dụng với axit sunfuric thì thu đc 5,6 lít khí đktc, sau khi phản ứng kết thúc thu đc 6,25 g chất rắn không tan a) tính% khối lượng mỗi kim loại có trong hỗn hợp ban đầu
a)
Chất rắn không tan là Ag
mAg = 6,25 (g)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
0,25<----------------------0,25
=> mZn = 0,25.65 = 16,25 (g)
\(\%m_{Zn}=\dfrac{16,25}{16,25+6,25}.100\%=72,22\%\Rightarrow\%m_{Ag}=100\%-72,22\%=27,78\%\)
Đúng 4
Bình luận (0)
a) \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
6,25 gam chất rắn không tan là Ag không tham gia phản ứng => mAg = 6,25 (g)
PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
0,25<--------------------------0,25
=> mZn = 0,25.65 = 16,25 (g)
=> \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{16,25}{16,25+6,25}.100\%=72,22\%\\\%m_{Ag}=100\%-72,22\%=27,78\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
\(Ag+H_2SO_4.ko.pứ\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
0,25 0,25 0,25 0,25
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
rắn ko tan: Ag
=> \(m_{Ag}=6,25\left(g\right)\)
=> \(\%_{m_{Zn}}=\dfrac{0,25.65.100}{0,25.65+6,25}=72,22\%\)
=> \(\%_{m_{Ag}}=100-72,22=27,78\%\)
Đúng 1
Bình luận (0)
Câu 3 Trộn 200ml dung dịch MgCl2 0,15M với 300ml dung dịch NaOH phản ứng vừa đủ . Sau phản ứng lọc hết kết tủa nung đến khối lượng ko đổi đc m gam chất rắn a Viết Phương trình phản ứng xảy ra b Tính m Tính Cm của các chất có trog dung dịch sau khi lọc kết tủa(coi V ko đổi)
Giúp với mai mik thi
Câu 3:
a, PT: \(MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_{2\downarrow}+2NaCl\)
\(Mg\left(OH\right)_2\underrightarrow{t^o}MgO+H_2O\)
b, Ta có: \(n_{MgCl_2}=0,2.0,15=0,03\left(mol\right)\)
Theo PT: \(n_{MgO}=n_{Mg\left(OH\right)_2}=n_{MgCl_2}=0,03\left(mol\right)\)
\(\Rightarrow m=m_{MgO}=0,04.40=1,2\left(g\right)\)
Theo PT: \(n_{NaCl}=2n_{MgCl_2}=0,06\left(mol\right)\)
\(\Rightarrow C_{M_{NaCl}}=\dfrac{0,06}{0,2+0,3}=0,12\left(M\right)\)
Đúng 0
Bình luận (0)
Hãy tính khối lượng dd hcl 3,65% cần dùng để trung hoà hêtd 50gam dd ca(oh)2 7,4% và tính nồng độ % của dd muối thu đc( ca= 40, O=16, h=1, cl=35,5
Trình bày phương pháp hoá học để phân biệt dd sau: hcl, koh, ba(oh)2
Dùng quỳ tím
Quỳ chuyển sang màu xanh: KOH, Ba(OH)2(*)
Quỳ chuyển sang màu đỏ: HCl
Dùng tiếp Na2SO4 để phân biệt (*)
Xuất hiện kết tủa trắng BaSO4-) BaCl2
Đúng 0
Bình luận (0)
Câu 1: Cho 200ml dd K2SO4 1M vào 150ml dd Ba(OH)2 1M
a/ Viết PTPƯ xảy ra
b/ Tính khối lượng kết tủa thu được
c/ Tính nồng độ mol của các chất có trong dd sau phản ứng (biết rằng thể tích dd thay đổi không đáng kể)
Câu 2: Nhỏ vài giọt dd bạc nitrat vào ống nghiệm đựng dd Natri clorua. Nêu hiện tượng quan sát được? Viết PTHH xảy ra (nếu có)
Câu 1:
a, PT: \(K_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_{4\downarrow}+2KOH\)
b, Ta có: \(n_{K_2SO_4}=0,2.1=0,2\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,15.1=0,15\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,15}{1}\), ta được K2SO4 dư.
Theo PT: \(n_{BaSO_4}=n_{Ba\left(OH\right)_2}=0,15\left(mol\right)\)
\(\Rightarrow m_{BaSO_4}=0,15.233=34,95\left(g\right)\)
c, Theo PT: \(\left\{{}\begin{matrix}n_{K_2SO_4\left(pư\right)}=n_{Ba\left(OH\right)_2}=0,15\left(mol\right)\\n_{KOH}=2n_{Ba\left(OH\right)_2}=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{K_2SO_4\left(dư\right)}}=\dfrac{0,2-0,15}{0,2+0,15}=\dfrac{1}{7}\left(M\right)\\C_{M_{KOH}}=\dfrac{0,3}{0,2+0,15}=\dfrac{6}{7}\left(M\right)\end{matrix}\right.\)
Câu 2:
- Hiện tượng: Xuất hiện kết tủa trắng.
PT: \(AgNO_3+NaCl\rightarrow NaNO_3+AgCl_{\downarrow}\)
Đúng 1
Bình luận (0)
Câu 1: Hoàn thành sơ đồ chuyển hóa sau:a/ Al ------ Al2O3 ------ Al2(SO4)3 ------- AlCl3 ------ Al(OH)3b/ Mg ------ MgCl2 ------ Mg(NO3)2 ----- MgSO4 ------ MgCO3 ------ MgOc/ Ca ----- Ca(OH)2 ----- CaO ---- CaCO3 ----- Ca(HCO3)2 ------ CaCO3d/ Cu ------ CuO ----- CuCl2 ----- Cu(NO3)2 ------ Cu(OH)2 ----- CuOe/ CuSO4 ----- CuCl2 ---- Cu(OH) ----- CuO ----- Cu ----- CuSO4f/ Na ----- Na2O ----- NaOH ----- NaCl ----- NaNO3
Đọc tiếp
Câu 1: Hoàn thành sơ đồ chuyển hóa sau:
a/ Al ------> Al2O3 ------> Al2(SO4)3 -------> AlCl3 ------> Al(OH)3
b/ Mg ------> MgCl2 ------> Mg(NO3)2 -----> MgSO4 ------> MgCO3 ------> MgO
c/ Ca -----> Ca(OH)2 -----> CaO ----> CaCO3 -----> Ca(HCO3)2 ------> CaCO3
d/ Cu ------> CuO -----> CuCl2 -----> Cu(NO3)2 ------> Cu(OH)2 -----> CuO
e/ CuSO4 -----> CuCl2 ----> Cu(OH) -----> CuO -----> Cu -----> CuSO4
f/ Na -----> Na2O -----> NaOH -----> NaCl -----> NaNO3
Câu 1: Trộn 200ml dung dịch MgCl2 0,15M với 300ml dung dịch NaOH phản ứng vừa đủ. Sau phản ứng lọc kết tủa nung đến khối lượng không đổi được m gam chất rắn:
a/ Viết PTPƯ xảy ra
b/ Tính m
c/ Tính CM của các chất có trong dung dịch sau khi lọc kết tủa (coi V không đổi)
a, PT: \(MgCl_2+2NaOH\rightarrow2NaCl+Mg\left(OH\right)_{2\downarrow}\)
\(Mg\left(OH\right)_2\underrightarrow{t^o}MgO+H_2O\)
b, Ta có: \(n_{MgCl_2}=0,2.0,15=0,03\left(mol\right)\)
Theo PT: \(n_{MgO}=n_{Mg\left(OH\right)_2}=n_{MgCl_2}=0,03\left(mol\right)\)
\(\Rightarrow m=m_{MgO}=0,03.40=1,2\left(g\right)\)
c, Theo PT: \(n_{NaCl}=2n_{MgCl_2}=0,06\left(mol\right)\)
\(\Rightarrow C_{M_{NaCl}}=\dfrac{0,06}{0,2+0,3}=0,12\left(M\right)\)
Đúng 1
Bình luận (0)
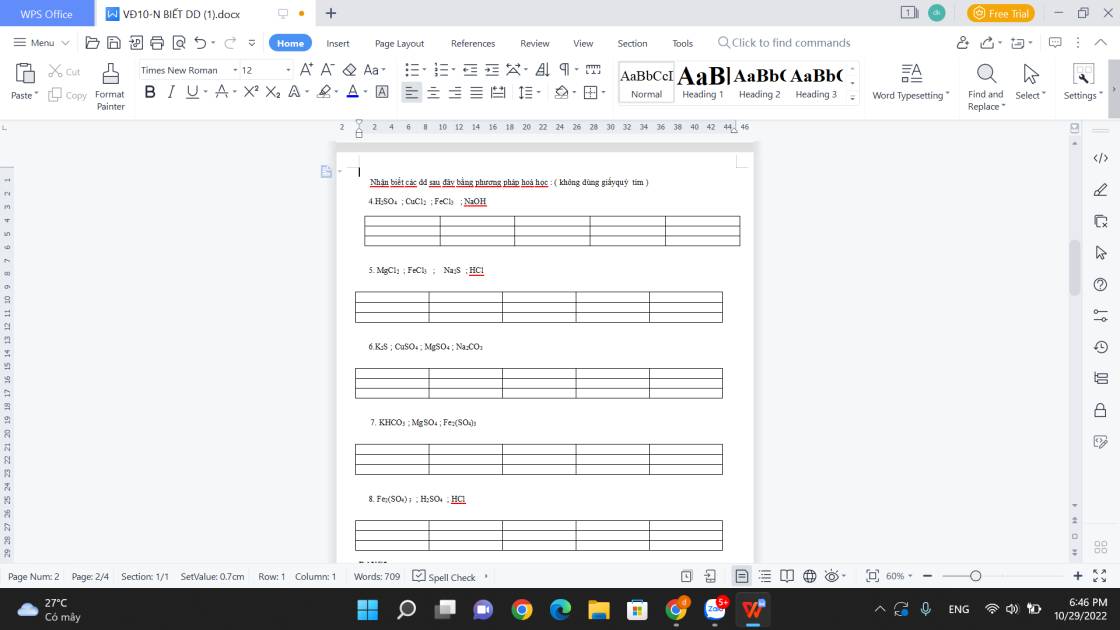
4. - Trích mẫu thử.
- Nhỏ 1 lượng từng mẫu thử vào dd BaCl2.
+ Xuất hiện kết tủa: H2SO4.
PT: \(BaCl_2+H_2SO_4\rightarrow2HCl+BaSO_{4\downarrow}\)
+ Không hiện tượng: CuCl2, FeCl3, NaOH. (1)
- Nhỏ 1 lượng mẫu thử nhóm (1) vào dd NaOH.
+ Xuất hiện kết tủa xanh: CuCl2.
PT: \(CuCl_2+2NaOH\rightarrow2NaCl+Cu\left(OH\right)_{2\downarrow}\)
+ Xuất hiện kết tủa nâu đỏ: FeCl3.
PT: \(FeCl_3+3NaOH\rightarrow3NaCl+Fe\left(OH\right)_{3\downarrow}\)
+ Không hiện tượng: NaOH.
- Dán nhãn.
5. - Trích mẫu thử.
- Nhỏ 1 lượng mẫu thử vào dd CuCl2.
+ Xuất hiện kết tủa đen: Na2S.
PT: \(CuCl_2+Na_2S\rightarrow2NaCl+CuS_{\downarrow}\)
+ Không hiện tượng: MgCl2, FeCl3 và HCl (1)
- Nhỏ 1 lượng mẫu thử nhóm (1) vào dd NaOH.
+ Xuất hiện kết tủa trắng: MgCl2.
PT: \(MgCl_2+2NaOH\rightarrow2NaCl+Mg\left(OH\right)_{2\downarrow}\)
+ Xuất hiện kết tủa nâu đỏ: FeCl3.
PT: \(FeCl_3+3NaOH\rightarrow3NaCl+Fe\left(OH\right)_{3\downarrow}\)
+ Không hiện tượng: HCl.
PT: \(HCl+NaOH\rightarrow NaCl+H_2O\)
- Dán nhãn.
6. - Trích mẫu thử.
- Nhỏ 1 lượng từng mẫu thử vào dd HCl.
+ Xuất hiện khí có mùi trứng thối: K2S.
PT: \(K_2S+2HCl\rightarrow2KCl+H_2S\)
+ Xuất hiện khí không màu, không mùi: Na2CO3.
PT: \(Na_2CO_3+2HCl\rightarrow2NaCl+CO_2+H_2O\)
+ Không hiện tượng: CuSO4, MgSO4. (1)
- Nhỏ 1 lượng mẫu thử nhóm (1) vào dd NaOH.
+ Xuất hiện kết tủa xanh: CuSO4.
PT: \(CuSO_4+2NaOH\rightarrow Na_2SO_4+Cu\left(OH\right)_{2\downarrow}\)
+ Xuất hiện kết tủa trắng: MgSO4.
PT: \(MgSO_4+2NaOH\rightarrow Na_2SO_4+Mg\left(OH\right)_{2\downarrow}\)
- Dán nhãn.
Đúng 1
Bình luận (0)
7. - Trích mẫu thử.
- Nhỏ 1 lượng từng mẫu thử vào dd NaOH.
+ Xuất hiện kết tủa trắng: MgSO4.
PT: \(MgSO_4+2NaOH\rightarrow Na_2SO_4+Mg\left(OH\right)_{2\downarrow}\)
+ Xuất hiện kết tủa nâu đỏ: Fe2(SO4)3.
PT: \(Fe_2\left(SO_4\right)_3+6NaOH\rightarrow3Na_2SO_4+2Fe\left(OH\right)_{3\downarrow}\)
+ Không hiện tượng: KHCO3.
PT: \(2KHCO_3+2NaOH\rightarrow K_2CO_3+Na_2CO_3+2H_2O\)
- Dán nhãn.
8. - Trích mẫu thử.
- Nhỏ 1 lượng mẫu thử vào dd BaCl2.
+ Xuất hiện kết tủa trắng: Fe2(SO4)3 và H2SO4. (1)
PT: \(3BaCl_2+Fe_2\left(SO_4\right)_3\rightarrow2FeCl_3+3BaSO_{4\downarrow}\)
\(H_2SO_4+BaCl_2\rightarrow2HCl+BaSO_{4\downarrow}\)
+ Không hiện tượng: HCl.
- Nhỏ 1 lượng mẫu thử nhóm (1) vào dd NaOH.
+ Xuất hiện kết tủa nâu đỏ: Fe2(SO4)3
PT: \(Fe_2\left(SO_4\right)_3+6NaOH\rightarrow3Na_2SO_4+2Fe\left(OH\right)_{3\downarrow}\)
+ Không hiện tượng: H2SO4.
PT: \(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
- Dán nhãn.
Đúng 1
Bình luận (0)
cho 4,78g NA2CO3 tác dụng vừa đủ với 200 ml dd H2SO4 aM. Kết thúc thu được V lít khí ở đktc và dd chứa x gam muối, TÍnh các giá trị V và x
\(n_{Na_2CO_3}=\dfrac{4,78}{106}\approx0,045\left(mol\right)\)
Bạn coi lại đề nha kết quả ra hơi xấu
PTHH : Na2CO3 + H2SO4 -> Na2SO4 + H2O + CO2 \(\uparrow\)
0,045 0,045 0,045 0,045
\(V_{CO_2}=0,045.22,4=1,008\left(l\right)\)
\(m_{Na_2SO_4}=0,045.142=6,39\left(g\right)\)
\(C_{M_{dd}H_2SO_4}=\dfrac{0,045}{0,2}=0,225M\)
Đúng 1
Bình luận (0)