Cho \(H_2\) dư qua hỗn hợp \(Al_2O_3\) và CuO đun nóng, thu được hỗn hợp rắn X. Trong rắn X chứa:
A. Al2O3, CuO.
B. Al2O3, Cu.
C. Al, CuO.
D. Al, Cu
Cho \(H_2\) dư qua hỗn hợp \(Al_2O_3\) và CuO đun nóng, thu được hỗn hợp rắn X. Trong rắn X chứa:
A. Al2O3, CuO.
B. Al2O3, Cu.
C. Al, CuO.
D. Al, Cu
Nào chúng ta lại ngủ ngon với 1 câu hóa học mang nặng hướng logic tư duy nào :3
Một mẩu nhôm đặt trong không khí 1 thời gian dài bị oxi hóa thành hỗn hợp $Al_2O_3$ và $Al(OH)_3$, đem trộn chúng với Li, Na và K thu được hỗn hợp X. Hòa tan hoàn toàn hỗn hợp X vào nước dư, thu được dung dịch Y và 0,036 mol khí $H_2$. Cho từ từ đến hết dung dịch bao gồm 0,02 mol $H_2SO_4$; 0,01 mol $HCl$ và 0,01 mol $HNO_3$ vào Y thì thấy kết tủa max là m(g) rồi bị hòa tan mất 1 phần và thu được dung dịch Z (chỉ chứa các muối clorua, nitrat và sunfat trung hòa). Lượng kết tủa bị hòa tan là bao nhiêu?
(Dựa trên đề thi THPTQG năm 2018 - Đề chính thức)
Cho 25.5g hỗn hợp X gồm CuO và \(Al_2O_3\) tan hoàn toàn trong dung dịch \(H_2SO_4\) thì thu được dung dịch chứa 57.9g hỗn hợp muối gồm \(CuSo_4\) và \(Al_2\left(SO_4\right)_3\).
Tính số phần trăm \(Al_2O_3\) trong hỗn hợp X ?Biết sơ đồ phản ứng là:
CuO + \(H_2SO_4\) -----> \(CuSo_4\) +H2O
\(Al_2O_3\) +\(H_2SO_4\)------->\(Al_2\left(SO_4\right)_3\)+H2O.
Nhắc nhở Đề thi đại học vào khối A năm 2013
ailàm giúp mink với
ai làm được thì nhờ thầy cô tặng nhiều gp vô
CuO + H2SO4 → CuSO4 + H2O (1)
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O (2)
Gọi \(x,y\) lần lượt là số mol của CuO và Al2O3
Theo PT1: \(n_{CuSO_4}=n_{CuO}=x\left(mol\right)\)
TheoPT2: \(n_{Al_2\left(SO_4\right)_3}=n_{Al_2O_3}=y\left(mol\right)\)
Ta có: \(\left\{{}\begin{matrix}160x+342y=57,9\\80x+102y=25,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,255\\y=0,05\end{matrix}\right.\)
Vậy \(n_{CuO}=0,255\left(mol\right);n_{Al_2O_3}=0,05\left(mol\right)\)
\(\Rightarrow m_{Al_2O_3}=0,05\times102=5,1\left(g\right)\)
\(\Rightarrow\%Al_2O_3=\dfrac{5,1}{25,5}\times100\%=20\%\)
`a,`
`Al_2O_3 + 3H_2SO_4 -> Al_2(SO_4)_3 + 3H_2O `
`n_{Al_2O_3} = (20,4)/(102)=0,2(mol)`
`n_{H_2SO_4}=(17,64)/(98)=0,18(mol)`
Ta có:
`n_{Al_2O_3} (=(0,2)/1) > n_{H_2SO_4}(=(0.18)/3)`
`=>Al_2O_3` dư, `H_2SO_4` hết
theo pt:
`n_{Al_2O_3 dư} = 0,2 – (0,18)/3 =0,14(mol)`
`=> m_{Al_2O_3 dư} =0,14.102=14,28(g)`
`b,`
`n_{Al_2(SO_4)_3}=(0,18)/3=0,06(mol)`
`=> m_{Al_2(SO_4)_3}=0,06.342=20,52(g)`
Cho 32,6 g hỗn hợp gồm Fe và \(Al_2O_3\) vào m gam dd Axit clohidric 20%. Sau phản ứng thu được dd A và 8,96 lít khí B(đktc).
a) Tính % theo khối lượng mỗi chất trong hỗn hợp đầu
b) Tính m
nH2 = 8,96/22,4 = 0,4 mol
\(\text{PTHH: Fe + 2HCl → FeCl2 + H2 }\)
Tỉ lệ: 0,4 ← 0,8 ← 0,4 (mol)
→ mAl2O3 = 32,6 - 0,4.56 = 10,2 (g)
→ nAl2O3 = 10,2/102 = 0,1 mol
\(\text{ Al2O3 + 6HCl → 2AlCl3 + 3H2O}\)
0,1 → 0,6
a) %mFe = \(\frac{0,4.56}{32,6}.100\%\text{= 68,7%}\)
\(\text{%mAl2O3 = 100% - 68,7% = 31,3%}\)
b) Ta có: nHCl pư = \(\text{0,8 + 0,6 = 1,4 mol}\)
→ \(\text{mHCl = 1,4.36,5 = 51,1 (g)}\)
→ m dd HCl = 51,1.(100/20) = 255,5 (g)
Cho m(g) hỗn hợp Mg, \(Al_2O_3\) vào cốc chứa \(H_2SO_4\) . Sau khi tan hết thu được 1,344(l) \(H_2\) ở đktc và cốc chứa 17,46(g) muối. Tính m
Đốt 2,7g Al trong bình chứa 2,24l \(O_2\)( ở đktc ) thu được bao nhiêu g \(Al_2O_3\), biết phản ứng xảy ra hoàn toàn
Ta có :
\(n_{Al} = \dfrac{2,7}{27} = 0,1(mol)\\ n_{O_2} = \dfrac{2,24}{22,4} = 0,1(mol)\\ 4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3\)
Ta thấy : \(\dfrac{n_{Al}}{4} = 0,025 < \dfrac{n_{O_2}}{3} =0,03\) nên O2 dư.
\(n_{Al_2O_3} = 0,5n_{Al} = 0,05(mol)\\ \Rightarrow m_{Al_2O_3} = 0,05.102 = 5,1(gam)\)
\(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
\(n_{O_2\left(đktc\right)}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: \(4Al+3O_2\rightarrow2Al_2O_3\)
Ta có tỉ lệ: \(\dfrac{0,1}{4}< \dfrac{0,1}{3}\)
-> \(O_2\) sẽ dư sau phản ứng.
Theo pthh: \(n_{Al_2O_3}=\dfrac{2}{4}n_{Al}=\dfrac{1}{2}.0,1=0,05\left(mol\right)\)
-> \(m_{Al_2O_3}=0,05.102=5,1\left(g\right)\)
Thực hiện chuỗi phản ứng sau:
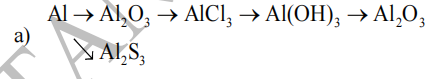
b) \(Al_2O_3\rightarrow Al\rightarrow Al_2\left(SO_4\right)_3\rightarrow AlCl_3\rightarrow Al\left(OH\right)_3\rightarrow Al_2O_3\)
c) \(Al\rightarrow AlCl_3\rightarrow Al\left(OH\right)_3\rightarrow Al_2O_3\rightarrow Al_2\left(SO_4\right)_3\rightarrow AlCl_3\)
a)\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(2AlCl_3+3Ba\left(OH\right)_2\rightarrow2Al\left(OH\right)_3\downarrow+3BaCl_2\)
\(2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
\(2Al+3S\underrightarrow{t^o}Al_2S_3\)
hòa tan 5,1 gam \(Al_2O_3\) vào 200ml dung dịch \(H_2SO_4\) nồng độ 1M. tính nồng độ các chất trong dung dịch thu được. gải sử thể tích dung dịch không đổi khi hòa tan \(Al_2O_3\)
Viết pt hoàn thành sơ đồ phản ứng sau:
1 2 3 4 5
Al → \(Al_2O_3\)→\(AlCl_3\)→\(Al\left(OH\right)_3\)→\(Al_2O_3\)→Al
\(4Al+3O_2->2Al_2O_3\)
\(Al_2O_3+6HCl->2AlCl_3+3H_2\)
\(\left(1\right)4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\\left(2\right)Al_2O_3+6HCl\rightarrow 2AlCl_3+3H_2O\\ \left(3\right)AlCl_3+3KOH\rightarrow Al\left(OH\right)_3+3KCl\\ \left(4\right)2Al\left(OH\right)_3\rightarrow\left(t^o\right)Al_2O_3+3H_2O\\ \left(5\right)2Al_2O_3\rightarrow\left(\text{đ}pnc,xt\right)4Al+3O_2\)