Nhiệt phân hoàn toàn muối nitrat của NaNO3 thu 0,2 mol khí. Tính khối lượng khí nitrat
PP
Những câu hỏi liên quan
Nhiệt phân hoàn toàn R(NO3)2 thu được 8 gam oxit kim loại và 5,04 lít hỗn hợp khí X. Khối lượng của hỗn hợp khí X là 10 gam. Công thức của muối nitrat đem nhiệt phân là: A. Fe(NO3)2 B. Mg(NO3)2 C. Cu(NO3)2 D. Zn(NO3)2
Đọc tiếp
Nhiệt phân hoàn toàn R(NO3)2 thu được 8 gam oxit kim loại và 5,04 lít hỗn hợp khí X. Khối lượng của hỗn hợp khí X là 10 gam. Công thức của muối nitrat đem nhiệt phân là:
A. Fe(NO3)2
B. Mg(NO3)2
C. Cu(NO3)2
D. Zn(NO3)2
Đáp án A
Vì nhiệt phân R(NO3)2 thu được oxit kim loại nên hỗn hợp khí X thu được gồm NO2 và O2.
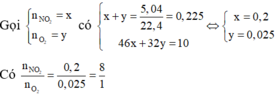
Do đó hóa trị của R trong muối và trong oxit là khác nhau. Căn cứ vào 4 đáp án ta được Fe(NO3)2.
Đúng 0
Bình luận (0)
Nhiệt phân hoàn toàn 34,6 gam hỗn hợp muối bạc nitrat và đồng nitrat, thu được chất rắn X. Cho X tác dụng hoàn toàn với dung dịch HNO3 dư, thu được 448 ml khí NO (đktc) duy nhất. Phần trăm khối lượng các chất trong hỗn hợp đầu làA. 73% và 26,934%. B. 72,245% và 27,755%.C. 68,432 và 31,568%. D. 70,52% và 29,48%.
Đọc tiếp
Nhiệt phân hoàn toàn 34,6 gam hỗn hợp muối bạc nitrat và đồng nitrat, thu được chất rắn X. Cho X tác dụng hoàn toàn với dung dịch HNO3 dư, thu được 448 ml khí NO (đktc) duy nhất. Phần trăm khối lượng các chất trong hỗn hợp đầu là
A. 73% và 26,934%. B. 72,245% và 27,755%.
C. 68,432 và 31,568%. D. 70,52% và 29,48%.
Cho 2.16g Mg tác dụng với dung dịch HNO3 dư,Sau khi phản ứng xảy ra hoàn toàn thu dược 0.896 lít khí NO (đktc) và dung dịch X .Tính khối lượng muối khan thu được khi làm bay hơi dung dich X?
32.Nhiệt phân 9.4g một muối nitrat của kim loại M đến khối lượng không đổi ,thu được chất răn nặng 4g .xá định công thữ muối nitrat
nMg= 0.09 mol
nNO= 0.04 mol
Mg----> Mg2+ + 2e
0.09 ----------------------------0.18
N+5 + 3e-----------.> N+2
0.12<--------0.04
vi số mol e nhận < số mol e nhường----> sản phâm muối còn có NH4NO3
gọi x là số mol của NH4NO3
N+5 +8e-----------> N-3
8x<------------x
Theo bao toàn e ta có: 8x + 0.12= 0.18 +> x= 0.0075
==> m NH4No3 = 0.0075 x 80=.........
m Mg(NO3)2= 0.09 x 148=......
khối luọng muói tạo thành = m Mg(NO3)2 + m NH4No3 =......
Đúng 0
Bình luận (0)
n NaOH = 0,03 mol
1)
Trong Z chứa: NaAlO2 + NaOH dư có tổng số mol = 0,03 mol
Z tác dụng vs HCl đến khi xuất hiện kết tủa thì ngừng => phản ứng hết NaOH dư => nNaOH dư = n HCl = 0,01 mol
=> n NaAlO2 = 0,03 -0,01 = 0,02 mol => nAl2O3 = 0,01 mol
2)
+) Phần 1 của Y
nH2SO4 = 0,03 mol = nCuO + nFeO
+) Phần 2 của Y
Hỗn hợp khí thoát ra là CO2 và CO dư
Theo sơ đồ chéo tính được n CO2 = 2nCO và tổng số mol khí = 0,03
=> nCO2 = 0,02 mol
=> m Hỗn hợp oxit ban đầu = 2+ 0,02.16 = 2,32 g
Ta có hệ phương trình:
x+y = 0,03
72x + 80y= 2,32
=> x = 0,01 y =0,02
=> trong hỗn hợp ban đầu: n FeO = 0,02 mol. nCuO = 0,04 mol
Đúng 0
Bình luận (0)
Nhiệt phân (trong chân không) hoàn toàn 27,1 gam hỗn hợp hai muối nitrat của hai kim loại hóa trị II (không đổi). Sau khi phản ứng kết thúc thu được 0,3 mol khí và hỗn hợp rắn. Dẫn luồng khí H2 (dư) qua hỗn hợp rắn sau phản ứng thì thấy lượng H2 phản ứng là 0,1 mol và còn lại 13,1 gam chất rắn. Công thức của hai muối nitrat trong hỗn hợp ban đầu là A. Ba(NO3)2 và Zn(NO3)2 B. Zn(NO3)2 và Cu(NO3)2 C. Cu(NO3)2 và Mg(NO3)2 D. Ca(NO3)2 và Zn(NO3)2
Đọc tiếp
Nhiệt phân (trong chân không) hoàn toàn 27,1 gam hỗn hợp hai muối nitrat của hai kim loại hóa trị II (không đổi). Sau khi phản ứng kết thúc thu được 0,3 mol khí và hỗn hợp rắn. Dẫn luồng khí H2 (dư) qua hỗn hợp rắn sau phản ứng thì thấy lượng H2 phản ứng là 0,1 mol và còn lại 13,1 gam chất rắn. Công thức của hai muối nitrat trong hỗn hợp ban đầu là
A. Ba(NO3)2 và Zn(NO3)2
B. Zn(NO3)2 và Cu(NO3)2
C. Cu(NO3)2 và Mg(NO3)2
D. Ca(NO3)2 và Zn(NO3)2
Đáp án D
Vì hỗn hợp rắn sau phản ứng nhiệt phân có phản ứng với H2 nên trong hỗn hợp đó có chứa oxit của kim loại có khả năng phản ứng với H2.
Có thể coi quá trình khử diễn ra đơn giản như sau:
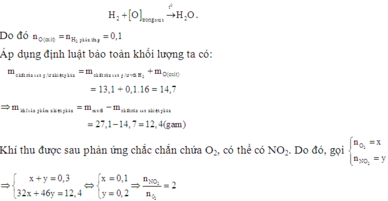

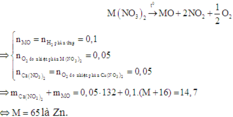
Vậy hai muối cần tìm là Ca(NO3)2 và Zn(NO3)2.
Nhận xét: Khi đến bước xác định được hỗn hợp có Ca(NO3)2 thì quan sát 4 đáp án, các bạn có thể kết luận được ngay đáp án đúng là D.
Đúng 0
Bình luận (0)
Nhiệt phân (trong chân không) hoàn toàn 45 gam hỗn hợp hai muối nitrat của hai kim loại hóa trị II (không đổi). Sau khi phản ứng kết thúc thu được 0,5 mol khí và hỗn hợp rắn. Dẫn luồng khí H2 (dư) qua hỗn hợp rắn sau phản ứng thì thấy lượng H2 phản ứng là 0,1 mol và còn lại 21,8 gam chất rắn. Hai kim loại tạo thành 2 muối nitrat trong hỗn hợp muối ban đầu là: A. Ba và Zn B. Zn và Cu C. Cu và Mg D. Ca và Zn
Đọc tiếp
Nhiệt phân (trong chân không) hoàn toàn 45 gam hỗn hợp hai muối nitrat của hai kim loại hóa trị II (không đổi). Sau khi phản ứng kết thúc thu được 0,5 mol khí và hỗn hợp rắn. Dẫn luồng khí H2 (dư) qua hỗn hợp rắn sau phản ứng thì thấy lượng H2 phản ứng là 0,1 mol và còn lại 21,8 gam chất rắn. Hai kim loại tạo thành 2 muối nitrat trong hỗn hợp muối ban đầu là:
A. Ba và Zn
B. Zn và Cu
C. Cu và Mg
D. Ca và Zn
Vì hỗn hợp rắn sau phản ứng có phản ứng với H2 nên hỗn hợp này có chứa oxit kim loại. Có thể coi quá trình khử oxit kim loại bởi H2 diễn ra đơn giản như sau:

Vì trong sản phẩm rắn có oxit kim loại và nên cả hai muối trong hỗn hợp khi nhiệt phân đều tạo ra oxit kim loại tương ứng (hai kim loại hóa trị II không đổi).
Gọi công thức chung của hai muối là M ( N O 3 ) 2 .
M ( N O 3 ) 2 → t 0 M O + 2 N O 2 + 1 2 O 2
Do đó n M ( N O 3 ) 2 = n M O = 2 n O 2 = 0 , 2
Mà khi cho hỗn hợp oxit này phản ứng với H2 dư thì chỉ có 0,1 mol H2 phản ứng. Nên trong hỗn hợp oxit thu được chứa 0,1 mol oxit của kim loại đứng sau Al (bị khử bởi H2) và 0,1 mol oxit của kim loại đứng trước Al (không bị khử bởi H2) trong dãy hoạt động hóa học của kim loại.
Mà trong các kim loại đứng trước Al trong dãy hoạt động hóa học của kim loại thì kim loại có hóa trị II không đổi và khi nhiệt phân muối nitrat của nó thu được oxit kim loại chỉ có Ba và Mg.
Nên trong hỗn hợp hai muối chứa Ba(NO3)2 hoặc Mg(NO3)2.
Vì số mol của mỗi oxit kim loại trong hỗn hợp đều là 0,1 nên khối lượng mol trung bình M là giá trị trung bình cộng khối lượng mol của hai kim loại.
Có M M ( N O 3 ) 2 = m n = 45 0 , 2 = 225 ⇒ M = 101
Gọi muối còn lại trong hỗn hợp ban đầu là R(NO3)2.
+) Nếu hỗn hợp muối có Mg(NO3)2 thì: 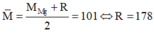 (loại)
(loại)
+) Nếu trong hỗn hợp muối chứa Ba(NO3)2 thì ta có: 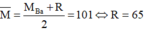
. Do đó hai kim loại cần tìm là Ba và Zn.
Đáp án A.
Đúng 0
Bình luận (0)
Nhiệt phân hoàn toàn 18,8g muối nitrat có hoá trị không đổi trong các hợp chất được 8 gam một oxit tương ứng . Kim loại cần tìm và khối lượng khí thu được lần lượt là: A. Fe và 8,8g B. Mg và 8,8g C. Cu và 10,8g D. Zn và 10,8g
Đọc tiếp
Nhiệt phân hoàn toàn 18,8g muối nitrat có hoá trị không đổi trong các hợp chất được 8 gam một oxit tương ứng . Kim loại cần tìm và khối lượng khí thu được lần lượt là:
A. Fe và 8,8g
B. Mg và 8,8g
C. Cu và 10,8g
D. Zn và 10,8g
Lời giải:
M(NO3)n → M2On
Pt: (M + 62n) → (2M + 16n) (gam)
Pư: 18,8 → 8 (gam)
⇒ 18,8.(2M + 16n) = 8(M + 62n)
⇒ M = 32n ⇒ n = 2 và M = 64 (Cu)
n Cu(NO3)2 = 0,1 mol
| 2Cu(NO3)2 |
→ |
2CuO |
+ |
4NO2 |
+ |
O2 |
0,1 → 0,2 0,05 (mol)
⇒ m = mNO2 + mO2 = 0,2.46 + 0,05.32 = 10,8g
Đáp án C.
Đúng 0
Bình luận (0)
Nhiệt phân hoàn toàn hỗn hợp 2 muối KNO3 và Cu(NO3)2 có khối lượng 5,4 gam. Sau khi phản ứng kết thúc thu được hỗn hợp khí X. Biết \(\overline{M_x}\)= 32,1818. Vậy khối lượng của mỗi muối nitrat trong hỗn hợp bằng:
A. 18 gam và 60 gam
B. 19,2 gam và 74,2 gam
C. 20,2gam và 75,2 gam
D. 30 gam và 70 gam
Hỗn hợp hơi gồm NO2 và O2.
Từ tỷ khối của hỗn hợp 32,1818, lập sơ đồ đường chéo
=>\(\dfrac{n_{NO_2}}{n_{O_2}}\) = \(\dfrac{909}{69091}\)
Đặt nKNO3 = a mol và nCu(NO3)2 = b mol
=> 101 a + 188 b = 5,4 gam.(1)
Nhiệt phân muối thu được : (0,5a + 0,5b) mol O2 và 2b mol NO2.
→ \(\dfrac{2b}{0,5a+0,5b}\) = \(\dfrac{909}{69091}\). (2).
=>a=0,05 ; b=1,76.10-4
Bạn xem lại đề !
Đúng 3
Bình luận (0)
Nung 6,06g kali nitrat ở nhiệt độ cao để phản ứng xảy ra hoàn toàn, cân lại chất rắn sau phản ứng thì thấy khối lượng chất rắn thu được là 5,1g.
PT pư chữ: Kali nitrat(rắn) --> Kali nitrat(rắn) + oxi (khí)
Em hãy giải thích vì sao khối lượng chất rắn giảm. Tính thể tích khí Oxi sinh ra (điều kiện thường) biết ở điều kiện thuwongfm 1 mol chất khí chiếm thể tích 24 lít.
Khối lượng rắn sau khi nung giảm do có khí O2 thoát ra
Theo ĐLBTKL: \(m_{KNO_3}=m_{KNO_2}+m_{O_2}\)
=> \(m_{O_2}=6,06-5,1=0,96\left(mol\right)\)
=> \(n_{O_2}=\dfrac{0,96}{32}=0,03\left(mol\right)\)
=> VO2 = 0,03.24 = 0,72 (l)
Đúng 6
Bình luận (0)
\(n_{KNO_3}=\dfrac{6,06}{101}=0,06mol\)
\(n_{KNO_2}=\dfrac{5,1}{85}=0,06mol\)
\(2KNO_3\underrightarrow{t^o}2KNO_2+O_2\)
0,06 0,06 0,03
Ở điều kiện thường, cứ 1 mol chất khí chiếm 24l về thể tích.
\(\Rightarrow\)0,03mol chất khí \(O_2\) có thể tích là:
\(V_{O_2}=0,03\cdot24=0,72l=720ml\)
Đúng 4
Bình luận (0)
Nhiệt phân hoàn toàn 7,26 gam muối nitrat của kim loại R hóa trị III, sau phản ứng thu được 2,4 gam oxit kim loại và hỗn hợp khí A.
a) Xác định kim loại R.
b) Hấp thụ toàn bộ khí A vào 100 ml H2O thu được dung dịch B. Tính pH của dung dịch B ?
Nhiệt phân hoàn toàn 10,1 gam một muối nitrat RNO3 đến khi phản ứng xảy ra hoàn toàn thu được 8,5 gam một chất rắn. Hãy xác định công thức của muối:
A. KNO3 B. NaNO3 C. LiNO3 D. AgNO3
Giả sử R là kim loại kiềm.
$2RNO_3 \xrightarrow{t^o} 2RNO_2 + O_2$
Theo PTHH :
$n_{RNO_3} = n_{RNO_2}$
$\Rightarrow \dfrac{10,1}{R + 62} = \dfrac{8,5}{R + 46}$
$\Rightarrow R = 39(Kali)$
Đáp án A
Đúng 0
Bình luận (0)




