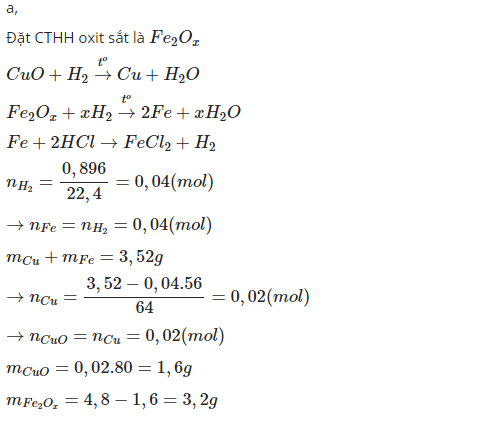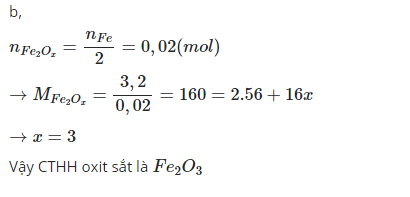Hòa tan 14,4 gam một oxit sắt trong dung dịch HCl dư thu được 25,4g muối. Xác định oxit sắt đó.
H24
Những câu hỏi liên quan
Bài 1:một hh A gồm al và Mg .Hoà tan m gam A trong dung dịch HCl dư thu được 10,08lít hidro. Nếu cũng hoà tan m gam A trong đ NaOH thấy còn lại 3,6g kim loại không tan. Tính m?
Bài2:Hoà tan 14,4g một oxit sắt trong dd HCl dư thu được 25,4g muối. Xác định oxit sắt đó
https://i.imgur.com/mapIvea.jpg
Đúng 0
Bình luận (0)
Cho 0,1 mol một oxit sắt tác dụng vừa đủ với dung dịch HCl 2M.
a. Xác định công thức của oxit sắt trên biết lượng muối thu được là 32,5 gam, từ đó tính thể tích của dung dịch HCl 2M cần dùng.
b. Lượng HCl dùng trong thí nghiệm trên có thể trung hòa bao nhiêu gam dung dịch Ba(OH)2 17,1%.
a)\(Fe_xO_y+2yHCl\rightarrow xFeCl_{\dfrac{2y}{x}}+yH2O\)
Ta có: \(n_{FeCl_{\dfrac{2y}{x}}}=xn_{Fe_xO_y}=0,1x\left(mol\right)\)
\(\Rightarrow M_{FeCl_{\dfrac{2y}{x}}}=\dfrac{32,5}{0,1x}\)
| x | 1 | 2 | 3 |
| \(M_{FeCl_{\dfrac{2y}{x}}}\) | 325(loại) | 162,5(TM) | 108,33(loại) |
=> Muối có CT: \(FeCl_2\Rightarrow\)CT oxit là FeO
\(FeO+2HCl\rightarrow FeCl_2+H2O\)
0,1---->0,2(mol)
\(\Rightarrow V_{HCl}=\dfrac{0,2}{2}=0,1\left(l\right)\)
b) \(Ba\left(OH\right)_2+2HCl\rightarrow BaCl_2+2H2O\)
0,1<---------------0,2
\(\Rightarrow m_{Ba\left(OH\right)2}=0,1.171=17,1\left(g\right)\)
\(\Rightarrow m_{dd}=\dfrac{17,1.100}{17,1}=100\left(g\right)\)
Chúc bạn học tốt ^^
Đúng 3
Bình luận (0)
bài 1 a/ Oxit X có công Thức RO3, tác dụng với dung dịch NaOH dư tạo 1 muối có chứa 22,54% R. Xác định CTHH của X.
b/ Để hòa tan 23,2g một oxit của sắt ( FexOy) cần dùng đủ 200ml dung dịch HCl 4M ( D=1,1 g/m). Xác định CTHH của oxit sắt và C% các muối trong dung dịch thu được
Để 11,2 gam sắt ngoài không khí thu được 14,4 gam chất rắn X gồm sắt và các oxit. Hòa tan hoàn toàn chất rắn X đó vào dung dịch H2SO4 đặc, nóng thì thu được bao nhiêu gam muối ?
\(n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)\\ \Rightarrow n_{Fe_2(SO_4)_3} = \dfrac{1}{2}n_{Fe} = 0,1(mol)\\ \Rightarrow m_{Fe_2(SO_4)_3} = 0,1.400 = 40(gam) \)
Đúng 3
Bình luận (2)
\(m_{O_2}=14.4-11.2=3.2\left(g\right)\)
\(n_{O_2}=\dfrac{3.2}{32}=0.1\left(mol\right)\)
\(O_2+4e\rightarrow2O^{2-}\)
\(0.1....0.4\)
\(S^{+6}+2e\rightarrow S^{+4}\)
\(.......0.4.....0.2\)
\(n_{H_2SO_4}=2\cdot0.2=0.4\left(mol\right)\)
\(n_{H_2O}=\dfrac{1}{2}n_{H_2SO_4}=\dfrac{0.4}{2}=0.2\left(mol\right)\)
\(BTKL:\)
\(m_{Muối}=14.4+0.4\cdot98-0.2\cdot64-0.2\cdot18=37.2\left(g\right)\)
Đúng 0
Bình luận (0)
Một hỗn hợp A có khối lượng 5,08g gồm CuO và một oxit của sắt. Hòa tan hoàn toàn A trong dd H 2 S O 4 đặc, nóng, dư thu được 0,168 lít khí S O 2 ở điều kiện tiêu chuẩn và dung dịch B chứa 12,2 gam muối sunfat. Xác định công thức của oxit sắt và % khối lượng từng oxit trong A?
Bài 2 : Cho 3,6 gam một oxit sắt vào dung dịch HCl dư.Sau phản ứng xảy ra hoàn hoàn thu được 6,35 gam một muối sắt clorua. Xác định công thức của sắtBài 3: Cho 10,4 gam oxit của một nguyên tố kim loại hoá trị 2 tác dụng với dung dịch HCl dư,sau p/ư tạo thành 15,9 gam muối.Xác định nguyên tố kim loạiBài 4 : Cho một dòng khí H2 dư qua 4,8 gam hỗn hợp CuO và một oxit sắt nung nóng thu được 3,52 gam chất rắn.Nếu cho chất rắn đó hoà tan trong axit HCl thì thu được 0,896 lít H2 (đktc).Xác định khối lư...
Đọc tiếp
Bài 2 : Cho 3,6 gam một oxit sắt vào dung dịch HCl dư.Sau phản ứng xảy ra hoàn hoàn thu được 6,35 gam một muối sắt clorua. Xác định công thức của sắt
Bài 3: Cho 10,4 gam oxit của một nguyên tố kim loại hoá trị 2 tác dụng với dung dịch HCl dư,sau p/ư tạo thành 15,9 gam muối.Xác định nguyên tố kim loại
Bài 4 : Cho một dòng khí H2 dư qua 4,8 gam hỗn hợp CuO và một oxit sắt nung nóng thu được 3,52 gam chất rắn.Nếu cho chất rắn đó hoà tan trong axit HCl thì thu được 0,896 lít H2 (đktc).Xác định khối lượng mỗi oxit trong hỗn hợp và xác đijnh công thức của oxit sắt.
Bài 5:
Thả 2,3 gam Na vào 200 gam dung dịch NaOH 5% thấy thoát ra khí.
a) Tính nồng độ % dung dịch sau p/ư
b) Tính nồng độ mol dung dịch sau p/ư biết thể tích là 200ml
Bài 6:
Thả 4 gam Ca vào 200 gam dung dịch NaOH 5% thấy thoát ra khí.
a) Tính nồng độ % dung dịch sau p/ư
b) Cho V=1 lít.Tính nồng độ mol mỗi chất sau p/ư
Cho một dòng khi hiđrô dư qua 4,8 gam hỗn hợp CuO và một oxit sắt nung nóng thu được 3,52 gam chất rắn. Đem chất rắn đó hòa tan trong axit HCl dư thu được 0,896 lit khi(dktc). a. Xác định khối lượng mỗi oxit trong hỗn hợp. b. Xác định công thức phân tử oxit sắt Giúp mình với!
PTHH: \(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\) (1)
\(Fe_xO_y+yH_2\xrightarrow[t^o]{}xFe+yH_2O\) (2)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) (3)
a) Ta có: \(n_{H_2\left(3\right)}=\dfrac{0,896}{22,4}=0,04\left(mol\right)=n_{Fe}\) \(\Rightarrow n_{Cu}=\dfrac{3,52-0,04\cdot56}{64}=0,02\left(mol\right)=n_{CuO}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{CuO}=0,02\cdot80=1,6\left(g\right)\\m_{Fe_xO_y}=4,8-1,6=3,2\left(g\right)\end{matrix}\right.\)
b) Theo PTHH: \(n_{Fe_xO_y}=\dfrac{0,04}{x}=\dfrac{3,2}{56x+16y}\)
\(\Rightarrow0,96x=0,64y\) \(\Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
Vậy CTPT cần tìm là Fe2O3
Đúng 2
Bình luận (0)
PTHH: CuO+H2to→Cu+H2OCuO+H2→toCu+H2O (1)
FexOy+yH2→toxFe+yH2OFexOy+yH2→toxFe+yH2O (2)
Fe+2HCl→FeCl2+H2↑Fe+2HCl→FeCl2+H2↑ (3)
a) Ta có: ⇒nCu=3,52−0,04⋅5664=0,02(mol)=nCuO⇒nCu=3,52−0,04⋅5664=0,02(mol)=nCuO
⇒{mCuO=0,02⋅80=1,6(g)mFexOy=4,8−1,6=3,2(g)⇒{mCuO=0,02⋅80=1,6(g)mFexOy=4,8−1,6=3,2(g)
b) Theo PTHH: ⇒xy=23⇒xy=23
Vậy CTPT cần tìm là Fe2O3
Đúng 0
Bình luận (0)
Cho một dòng khí hiđrô dư qua 4,8 gam hỗn hợp CuO và một oxit sắt nung nóng thu được 3,52 gam chất rắn. Đem chất rắn đó hòa tan trong axit HCl dư thu được 0,896 lit khí(đktc).
a. Xác định khối lượng mỗi oxit trong hỗn hợp.
b. Xác định công thức phân tử oxit sắt
Dùng khí H 2 dư để khử hoàn toàn m gam một oxit sắt, sau phản ứng thu được 5,4
gam nước. Lấy toàn bộ lượng kim loại thu được ở trên hòa tan vào dung dịch HCl dư thì
thu được 25,4 gam muối. Tìm công thức oxit sắt và tính giá trị của m?
Moi người giải thích từng bước cho em nếu đc,
em cảm ơn ạ
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\)
Bảo toàn O: \(n_{O\left(oxit\right)}=n_{H_2O}=0,3\left(mol\right)\)
\(n_{FeCl_2}=\dfrac{25,4}{127}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl ---> FeCl2 + H2
0,2 <-------------- 0,2
CTHH của oxit FexOy
=> x : y = 0,2 : 0,3 = 2 : 3
CTHH Fe2O3
Đúng 2
Bình luận (0)