Để khử 16g một oxit kim loại cần dùng hết 6,72l khí H2. Xác định CTHH của oxit đó.
TN
Những câu hỏi liên quan
khử hoàn toàn 16g oxit kim loại R2O3 bằng khí bằng khí H2 thấy tạo ra kim loại R và nước. Biết cần dùng vừa đủ 6,72l H2 (đktc). Tìm kim loại R
Giúp ik mn ơi :(((
\(n_{H_2} = \dfrac{6,72}{22,4} = 0,3(mol)\\ R_2O_3 + 3H_2 \xrightarrow{t^o} 2R + 3H_2O\\ n_{oxit} = \dfrac{1}{3}n_{H_2} = 0,1(mol)\\ M_{oxit} = 2R + 16.3 = \dfrac{16}{0,1} = 160 \Rightarrow R = 56(Fe)\\ \text{Vậy kim loại R là Fe}\)
Đúng 1
Bình luận (0)
Khử hoàn toàn 16g oxit của kim loại M có hóa trị II người ta dùng đúng 4,48 lít khí H₂ (đktc) thu được kim loại M. Xác định tên M và CTHH của oxit trên
pthh MO + H2 --> M + H2O
0,2 0,2 mol
nH2=4,48/22,4=0,2 mol
=> M\(_{MO}\)=16/0,2=80(g/mol)
=>M\(_M\) = 80-16 =64=> M là Cu => công thức oxit là CuO
Đúng 2
Bình luận (0)
Cần 6.72g H2 (đktc) để khử hết 16g oxit của một kim loại hóa trị III. Xác định công thức hóa học của oxiy
gọi oxit của kim loại là : A2O3
nH2=0,3mol
PTHH: A2O3+3H2=>2A+3H2O
0,1<- 0,3----->0,2
=> M(A2O3)=\(\frac{16}{2A+16.3}=0,1\)
<=>0,2A=11,2
=>A=56
=> Alaf Fe
=> công thức là Fe2O3
Đúng 1
Bình luận (0)
Một oxit của kim lạo có hóa trị III trong đó oxit chiếm 31.578%
a/ Xác định CTHH của oxit trên
b/ Tính thể tích H2 ( ĐKTC) cần dùng để điều chế 20.8 kim loại trong oxit trên
c/ Tính khối lượng của oxit kim loại đem dùng . Biết trong oxit này có chứa 5% tạp chất
a, Gọi CTHH: AxIIIOyII ⇒ A2O3 (Theo quy tắc hóa trị)
Ta có: %O = \(\dfrac{16.2}{16.2+2Ma}\).100%=31,578%
⇒ 0,31517(2MA + 48) =48 ⇒ 0,63156MA = 32,84256
⇒ MA ≈ 52 (Cr) (Cr có hóa trị III)
⇒ CT Oxit là: Cr2O3
Đúng 0
Bình luận (0)
b, nCr = 20,8/52 = 0,4 mol
PTPƯ: Cr2O3 + 3H2 ---> 2Cr + 3H2O
Ta có: 0,4 mol Cr ----> 0,6 mol H2
⇒ VH2 = 0,6 . 22,4 = 13,44 (l)
Vậy ...
Đúng 0
Bình luận (0)
c, M oxit đem dùng là: 95/100 . 152 =144,4 (g) (Trừ 5% tạp chất)
(Nếu dùng dữ kiện câu b, )
mCr2O3 = 152 . 0,2 = 30,4 (g)
M oxit đem dùng là: 95/100 . 30,4 = 28,88 (g)
Vậy ...
Đúng 0
Bình luận (0)
Khử hoàn toàn 11,6g một oxit sắt (FexOy) bằng khí H2 ở to cao thu được 8,4g sắt kim loại. Xác định CTHH của oxit sắt và tính VH2 (đktc) đã dùng
chỉ mik với các bn
\(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\\ n_O=\dfrac{11,6-0,15}{16}=0,2\left(mol\right)\)
CTHH: FexOy
\(\rightarrow x:y=n_{Fe}:n_O=0,15:0,2=3:4\)
CTHH: Fe3O4
PTHH: Fe3O4 + 4H2 --to--> 3Fe + 4H2O
0,2 0,15
=> VH2 = 0,2.22,4 = 4,48 (l)
Đúng 3
Bình luận (1)
\(n_{Fe}=\dfrac{8,4}{56}=0,15mol\)
\(n_{Fe_xO_y}=\dfrac{11,6}{56x+16y}\) mol
\(Fe_xO_y+yH_2\rightarrow\left(t^p\right)xFe+yH_2O\)
\(\dfrac{11,6}{56x+16y}\) \(\dfrac{11,6x}{56x+16y}\) ( mol )
\(\Rightarrow\dfrac{11,6x}{56x+16y}=0,15\)
\(\Leftrightarrow11,6x=8,4x+2,4y\)
\(\Leftrightarrow3,2x=2,4y\)
\(\Leftrightarrow4x=3y\)
\(\Leftrightarrow x=3;y=4\)
\(\Rightarrow CTHH:Fe_3O_4\)
\(\Rightarrow n_{H_2}=0,15.4:3=0,2mol\)
\(V_{H_2}=0,2.22,4=4,48l\)
Đúng 2
Bình luận (1)
Đốt cháy hoàn toàn 22g muối sunfua của kim loại M (có CTHH MS) bằng 1 lượng oxi dư đến phản ứng hoàn toàn thu được oxit A và khí B. Để khử hoàn toàn oxit A trên cần dùng 8,6 l khí hidro (đktc). Xác định CTHH của muối sunfua đã dùng ?
Đặt \(n_{MS}=\dfrac{22}{M_M+32}=a\left(mol\right)\)
\(n_{H_2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
PTHH: 2MS + \(\dfrac{n+4}{2}\)O2 --to--> M2On + 2SO2
a---------------------->0,5a----->a
M2On + nH2 --to--> 2M + nH2O
\(\dfrac{0,375}{n}\)<--0,375
=> \(0,5a=\dfrac{0,375}{n}\)
=> \(a=\dfrac{0,75}{n}=\dfrac{22}{M_M+32}\left(mol\right)\)
=> 0,75.MM + 24 = 22n
Xét n = 1 => Không thỏa mãn
Xét n = 2 => Không thỏa mãn
Xét n = 3 => MM = 56 (g/mol)
=> M là Fe
CTHH: FeS
Đúng 2
Bình luận (2)
bn check lại giúp mình xem 8,4 hay 8,6 lít khí hidro nhé :D
Đúng 0
Bình luận (1)
2RS+3O2t0→2RO+2SO22RS+3O2t0→2RO+2SO2
RO+H2SO4→RSO4+H2ORO+H2SO4→RSO4+H2O
Giả sử :
nH2SO4=1(mol)nH2SO4=1(mol)
⇒mddH2SO4=9824.5%=400(g)⇒mddH2SO4=9824.5%=400(g)
mdung dịch muối=R+16+400=R+416(g)mdung dịch muối=R+16+400=R+416(g)
C%RSO4=R+96R+416⋅100%=33.33%C%RSO4=R+96R+416⋅100%=33.33%
⇒R=64⇒R=64
R:CuR:Cu
nCuS=1296=0.125(mol)nCuS=1296=0.125(mol)
nCuSO4=nCuS=0.125(mol)nCuSO4=nCuS=0.125(mol)
mCuSO4=0.125⋅160=20(g)mCuSO4=0.125⋅160=20(g)
mdd=0.125⋅80+0.125⋅9824.5%=60(g)mdd=0.125⋅80+0.125⋅9824.5%=60(
Khối lượng dung dịch bão hòa còn lại :
60−15.625=44.375(g)60−15.625=44.375(g)
CT:CuSO4⋅nH2OCT:CuSO4⋅nH2O
mCuSO4=m(g)mCuSO4=m(g)
C%=m44.375⋅100%=22.54%C%=m44.375⋅100%=22.54%
⇒m=10⇒m=10
mCuSO4(tt)=20−10=10(g)
Đúng 0
Bình luận (1)
để khử hoàn toàn 11,6 gam 1 oxit kim loại M cần dùng 4,48 lít khí CO Sau pứ thu được m gam kim loại M .Hòa tan hết m gam kim loại M cần dùng dung dịch chứa 0,15mol H2SO4.tính CTHH của oxit
khi khử 10g một oxit kim loại hoá trị 2 bằng khí h2 thu được 8g kim loại xác định tên kim loại đó và thể tích h2(đktc) phải dùng
CTHH: XO
\(n_{XO}=\dfrac{10}{M_X+16}\left(mol\right)\)
\(n_X=\dfrac{8}{M_X}\left(mol\right)\)
PTHH: \(MO+H_2\underrightarrow{t^o}M+H_2O\)
____\(\dfrac{10}{M_X+16}\)-->\(\dfrac{10}{M_X+16}\)________(mol)
=> \(\dfrac{10}{M_X+16}=\dfrac{8}{M_X}\) => MX = 64 (g/mol)
=> Kim loại là Cu
\(n_{CuO}=\dfrac{10}{80}=0,125\left(mol\right)\)
PTHH: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
_____0,125-->0,125______________(mol)
=> \(V_{H_2}=0,125.22,4=2,8\left(l\right)\)
Đúng 1
Bình luận (0)
Đặt : CTHH : MO
MO + H2 -to-> M + H2O
M+16________M
10___________8
<=> 8(M+16) = 10M
<=> M = 64
Kim loại là : Cu
nH2 = nCuO = 10/80 = 0.125 (mol)
V H2 = 2.8 (l)
Đúng 0
Bình luận (0)
Khử 4,8 gam một oxit của kim loại trong dãy điện hóa ở nhiệt độ cao cần 2,016 lít khí H2 đktc . Kim loại thu được đem hòa tan trong dung dịch HCl thu được 1,344 lít khí H2 đktc . Hãy xác định công thức hóa học của oxit đã dùng: A. Fe2O3 B. MgO C. Fe3O4 D. Al2O3
Đọc tiếp
Khử 4,8 gam một oxit của kim loại trong dãy điện hóa ở nhiệt độ cao cần 2,016 lít khí H2 đktc . Kim loại thu được đem hòa tan trong dung dịch HCl thu được 1,344 lít khí H2 đktc . Hãy xác định công thức hóa học của oxit đã dùng:
A. Fe2O3
B. MgO
C. Fe3O4
D. Al2O3
Đáp án A
Oxit chưa biết của kim loại nào → Gọi MxOy
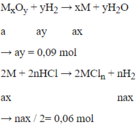
Mà : 56ax + 16ay = 4,8
→ ax = 0,06
→ x : y = ax : ay = 0,06 : 0,09 = 2 : 3 => M2O3
→ n = 0,12 : 0,06 = 2 => M hóa trị II
→ Chỉ có Fe thỏa mãn vì nó có hai hóa trị
Lưu ý: Bài toán này dễ nhầm lẫn nếu không để ý sự thay đổi hóa trị ở 2 phương trình.
Đúng 0
Bình luận (0)







