Nếu điều chế cùng một lượng thể tích khí oxi thì dùng chất nào có khối lượng nhỏ hơn.
NT
Những câu hỏi liên quan
Lấy cùng một lượng
K
C
l
O
3
và
K
M
n
O
4
để điều chế oxi. Chất nào tạo ra nhiều khí
O
2
hơn. Nếu điều chế dùng một thể tích khí oxi thì dùng chất nào kinh tế hơn? Biết rằng giá
K
M
n
O
4
là 30.000 đ/kg và
K
C
l...
Đọc tiếp
Lấy cùng một lượng K C l O 3 và K M n O 4 để điều chế oxi. Chất nào tạo ra nhiều khí O 2 hơn. Nếu điều chế dùng một thể tích khí oxi thì dùng chất nào kinh tế hơn? Biết rằng giá K M n O 4 là 30.000 đ/kg và K C l O 3 là 96.000 đ/kg.
Giả sử cần điều chế 3,36lit O 2 tương đương với 0,15 mol O 2
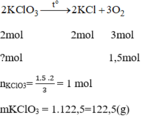
Số tiền mua 122,5g để điều chế 1,5mol O 2 :
0,1225.96000 = 11760 (đồng)
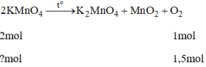
n K M n O 4 = 1,5 . 2 =3 mol
n K M n O 4 = 3.158 = 474 (g)
Số tiền mua 474g để điều chế 1,5 mol O 2 :
0,474.30000 = 14220(đồng)
Vậy để điều chế cùng 1 thể tích khí O 2 thì dùng K C l O 3 để điều chế kinh tế hơn mặc dù giá tiền cao mua 1 kg K C l O 3 cao hơn nhưng thể tích khí O 2 sinh ra nhiều hơn.
Đúng 0
Bình luận (0)
Để điều chế khí oxi người ta phân hủy KMnO4 và KCLO3 a/Để thu được lượng khí oxi như nhau,chất nào cần số mol nhiều hơn?Cần dùng khối lượng nhiều hơn? b/phân hủy cùng số mol,chất nào sinh ra khí nhiều hơn? c/phân hủy cùng khối lượng chất nào sinh ra khí oxi nhiều hơn? d/Biết giá thành 1kg KMnO4 là 200000đ,1kg KCLO3 là 300000đ,hãy cho biết để điều chế khí oxi như nhau,thì dùng chất nào có giá thành rẻ nhiều hơn?
Đọc tiếp
Để điều chế khí oxi người ta phân hủy KMnO4 và KCLO3
a/Để thu được lượng khí oxi như nhau,chất nào cần số mol nhiều hơn?Cần dùng khối lượng nhiều hơn?
b/phân hủy cùng số mol,chất nào sinh ra khí nhiều hơn?
c/phân hủy cùng khối lượng chất nào sinh ra khí oxi nhiều hơn?
d/Biết giá thành 1kg KMnO4 là 200000đ,1kg KCLO3 là 300000đ,hãy cho biết để điều chế khí oxi như nhau,thì dùng chất nào có giá thành rẻ nhiều hơn?
a)6KMnO4--->3K2MnO4 + 3MnO2 + 3O2 (1)
2KClO3---> 2KCl + 3O2 (2)
Dựa vào phương trình trên ---> thu cùng lượng O2, KMnO4 cần nhiều số mol hơn, và khối lượng nhiều hơn.
b)6KClO3-->6KCl + 9O2 (3)
1,3--->Cùng số mol, KClO3 cho nhiều O2 hơn.
c)Giả sử cả 2 chất cùng có khối lượng là 100g
nKMnO4=50/79(mol)
nKClO3=40/49
Thay vào các phương trình phản ứng tính ra mO2
Cụ thể: KMnO4 cho ra 800/79 (g) O2
KClO3 cho ra 1920/49 (g) O2
---> Cùng m thì KClO3 cho nhiều g O2 hơn.
d) Giả sử cần điều chế 32 g O2
--->nO2=1 mol
--->nKMnO4=2 mol--->mKMnO4=316g
và nKClO3=2/3 mol--->nKClO3=245/3g
Ta có:
-1000g KMnO4 <=> 200000đ
316 g=========>63200đ
-1000g KClO3 <=> 300000đ
245/3g========> 24500đ
Vậy để điều chế cùng lượng O2, KClO3 có giá thành rẻ hơn.
Đúng 0
Bình luận (0)
trong phòng thí nghiệm người ta điều chế khí oxi bằng cách nhiệt phân kmno4 hoặc kclo3 xúc tác mno2 .nếu thu được cùng thể tích oxi thì chất nào cần khối lượng lớn hơn
\(Coi\ n_{O_2} = 1(mol)\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{KMnO_4} = 2n_{O_2} = 2(mol) \\ m_{KMnO_4} = 2.158 =316(gam)\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{KClO_3} = \dfrac{2}{3}n_{O_2} = \dfrac{2}{3}(mol)\\ m_{KClO_3} = \dfrac{2}{3}.122,5 = 81,6(gam)\\ \Rightarrow m_{KMnO_4} > m_{KClO_3}(316<81,6)\)
Đúng 2
Bình luận (1)
KMnO4 cần khối lượng lớn hơn
Đúng 1
Bình luận (0)
Có những chất sau: KMnO4, MnO2, K2Cr2O7 và dung dịch HCl. a) Nếu các chất oxi hóa có khối lượng bằng nhau thì chọn chất nào có thể điều chế được lượng khí clo nhiều hơn? b) Nếu chất oxi hóa có số mol bằng nhau thì chọn chất nào có thể điều chế được lượng khí clo nhiều hơn? Hãy trả lời bằng cách tính toán trên cơ sở của các phương trình phản ứng.
Đọc tiếp
Có những chất sau: KMnO4, MnO2, K2Cr2O7 và dung dịch HCl.
a) Nếu các chất oxi hóa có khối lượng bằng nhau thì chọn chất nào có thể điều chế được lượng khí clo nhiều hơn?
b) Nếu chất oxi hóa có số mol bằng nhau thì chọn chất nào có thể điều chế được lượng khí clo nhiều hơn?
Hãy trả lời bằng cách tính toán trên cơ sở của các phương trình phản ứng.
a) Giả sử lấy lượng mỗi chất là a gam
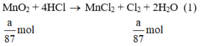
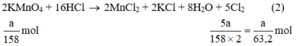
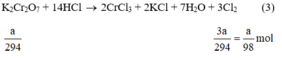
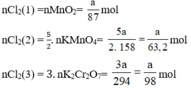
Ta có: 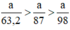
Lượng Cl2 điều chế được từ pt (2) nhiều nhất.
Vậy dùng KMnO4 điều chế được nhiều Cl2 hơn.
b) Nếu lấy số mol các chất bằng a mol
Theo (1) nCl2(1) = nMnO2 = a mol
Theo (2) nCl2(2) = 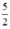 . nKMnO4 = 2,5a mol
. nKMnO4 = 2,5a mol
Theo (3) nCl2(3) = 3. nK2Cr2O7 = 3a mol
Ta có: 3a > 2,5a > a.
⇒ lượng Cl2 điều chế được từ pt (3) nhiều nhất.
Vậy dùng K2Cr2O7 được nhiều Cl2 hơn.
Đúng 0
Bình luận (0)
A) hãy xác định thể tích õi được sinh ra nhiều hơn khi lấy cùng một khối lượng kaliclorat; kalipenmanganat
B)để điều chế 8,96 lít oxi (đktc) thì chọn chất nào trong hai chất trên để có khối lượng nhỏ hơn
A) kalipenmanganat
B)kaliclorat
Đúng 0
Bình luận (0)
Để điều chế 4,48 lít khí oxi (đktc) trong phòng thí nghiệm, có thể dùng một chất trong hai chất KClO₃ và KMnO₄. Hãy tính toán và chọn chất có khối lượng nhỏ hơn nhằm tiết kiệm hơn.
nO2 = 4.48/22.4 = 0.2 (mol)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.4__________________________0.2
mKMnO4 = 0.2 * 158 = 31.6 (g)
2KClO3 -to-> 2KCl + 3O2
2/15______________0.2
mKClO3 = 2/15 * 122.5 = 16.33 (g)
mKClO3 < mKMnO4
=> Dùng KClO3 tiết kiệm hơn
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 3,6 gam magie trong khí oxi trên thì khối lượng kali clorat cần dùng.
A. Tính thể tích khí oxi (đktc) cần dùng?
B. Nếu dùng dịch KCLO3(có xúc tác MnO2) để điều chế lượng khí oxi trên thì khối lượng kali clorat cần dùng là bao nhiêu?
(O=16,CL=35,5,K=39,Mn=55)
2Mg+O2-to>2MgO
0,15---0,075 mol
2KClO3-to->2KCl+3O2
0,05-----------------------0,075
n Mg=\(\dfrac{3,6}{24}\)=0,15 mol
=>VO2=0,075.22,4=1,68l
=>m KClO3=0,05.122,5=6,125g
Đúng 3
Bình luận (0)
a. \(n_{Mg}=\dfrac{3.6}{24}=0,15\left(mol\right)\)
PTHH : 2Mg + O2 ----to----> 2MgO
0,15 0,075
\(V_{O_2}=0,075.22,4=1,68\left(l\right)\)
b. PTHH : 2KClO3 \(\xrightarrow[MnO_2]{t^o}\) 2KCl + 3O2
0,05 0,075
\(m_{KClO_3}=0,05.122,5=6,125\left(g\right)\)
Đúng 1
Bình luận (0)
Để điều chế cùng một lượng khí oxi trong phòng thí nghiệm, ta nên sử dụng nguyên liệu nào sau đây để khối lượng hóa chất cần dùng là nhỏ nhất?
bạn không nói rõ là nguyên liệu nào thì sao chọn được. Nhưng nếu so sánh giữa KMnO4,KClO3,KNO3 và H2O2 thì chọn H2O2 nhé
Đúng 0
Bình luận (2)
để điều chế cùng 1 thể tích khí oxi có thể nhiệt phân KMnO4 và KCLO3 . hãy cho biết khối lượng chất nào đã dùng là ít nhất . viết phương trình hóa học và giải thích ............. cần gấp
\(Coi\ n_{O_2} = 1(mol)\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 +O_2\\ n_{KMnO_4} = 2n_{O_2} = 2(mol)\\ m_{KMnO_4} = 2.158 = 316(gam)\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{KClO_3} = \dfrac{2}{3}n_{KClO_3} = \dfrac{2}{3}(mol)\\ m_{KClO_3} = \dfrac{2}{3}.122,5= 81,6(gam)\\ m_{KClO_3} < m_{KMnO_4} (81,6 <316)\\ \)
Đúng 4
Bình luận (0)
Trong phòng thí nghiệm có thể dùng những muối KClO3 hoặc KNO3 để điều chế khí oxi bằng phản ứng phân hủy.a) Viết các phương trình hóa học đối xới mỗi chất.b) Nếu dùng 0,1 mol mỗi chất thì thể tích khí oxi thu được có khác nhau hay không? Hãy tính thể tích khí oxi thu được.c) Cần điều chế 1,12 lít khí oxi, hãy tính khối lượng mỗi chất cần dùng.Các thể tích khí được đo ở điều kiện tiêu chuẩn.
Đọc tiếp
Trong phòng thí nghiệm có thể dùng những muối KClO3 hoặc KNO3 để điều chế khí oxi bằng phản ứng phân hủy.
a) Viết các phương trình hóa học đối xới mỗi chất.
b) Nếu dùng 0,1 mol mỗi chất thì thể tích khí oxi thu được có khác nhau hay không? Hãy tính thể tích khí oxi thu được.
c) Cần điều chế 1,12 lít khí oxi, hãy tính khối lượng mỗi chất cần dùng.
Các thể tích khí được đo ở điều kiện tiêu chuẩn.
a) Các phương trình phản ứng
2KNO3 2KNO2 + O2↑ (1)
2KClO3 2KCl + 3O2↑ (2)
b) Theo (1) và (2), thấy số mol hai muối tham gia phản ứng như nhau nhưng số mol oxi tạo thành khác nhau và do đó thể tích khí oxi thu được là khác nhau.
Theo (1): nO2 = nKNO3 =
= 0,05 mol; VO2 = 0,05x22,4 = 1,12 lít
Theo (2): nO2 = nKClO3 =
= 0,15 mol; VO2 = 0,15x22,4 = 3,36 lít
c) Để thu được 1,12 lít khí (0,05 mol) O2, thì:
Theo (1): nKNO3 = 2nO2 = = 0,1 mol; mKNO3 = 0,1x101 = 10,1 g
Theo (2): nKClO3 = nO2 =
x0,05 mol; VKClO3 =
x0,05x122,5 = 4,086 g.
Đúng 0
Bình luận (3)
a)
2KNO3 2KNO2 + O2↑ (1)
2KClO3 2KCl + 3O2↑ (2)
b)
Từ pt(1)=> nO2 = \(\frac{1}{2}\)nKNO3 = \(\frac{0,1}{2}\) = 0,05 mol
VO2 = 0,05.22,4 = 1,12 lít
Từ pt (2) => nO2 = \(\frac{3}{2}\)nKClO3 = \(\frac{0,1.3}{2}\) = 0,15 mol
V O2 = 0,15.22,4 = 3,36 lít
c)
Từ pt (1): nKNO3 = 2nO2 = = 0,1 mol
=>mKNO3 = 0,1.101 = 10,1 g
Từ pt (2): nKClO3 = \(\frac{2}{3}\)nO2 = \(\frac{2}{3}\).0,05 mol
V KClO3 = \(\frac{2}{3}\).0,05.122,5 = 4,086 g.
Đúng 0
Bình luận (0)







