Nêu hiện tượng xảy ra :
Đốt quặng pirit sắt cháy trong oxi dư và hấp thụ sản phẩm bằng nước brom dư
Đốt quặng pirit sắt trong oxi dư và hấp thụ sản phẩm khí bằng nước brom; dd H2S; dd Ca(OH)2 không dư
4FeS2 + 11O2 \(\underrightarrow{t^o}\) 2Fe2O3 + 8SO2
SO2 + 2H2O + Br2 \(\rightarrow\) 2HBr + H2SO4
SO2 + Ca(OH)2 \(\rightarrow\) CaSO3 + H2O
2SO2 + Ca(OH)2 \(\rightarrow\) Ca(HSO3)2
SO2 + 2H2S \(\rightarrow\) 3S + 2H2O
Giải thích hiện tượng (nếu có) và viết phương trình phản ứng xảy ra cho trường hợp sau: đốt cháy hoàn toàn quặng sắt pirit rồi dẫn sản phẩm khí qua bình đựng dd nước brom được dd X. Cho dd X tác dụng với BaCl2 dư.
2FeS+7\2O2-to->Fe2O3+2SO2
FeS cháy , có khí thoát ra , hỗn hợp còn lại màu nâu đen
SO2+Br2+H2O->H2SO4+HBr
dd màu vàng dần mất màu
H2SO4+BaCl2->BaSO4+HCl
có kết tủa suất hiện
HBr+BaCl2->ko td
Cách 2:
- Xuất hiện khí có mùi hắc bay lên :
\(4FeS_2+11O_2\underrightarrow{^{to}}8SO_2+2Fe_2O_3\)
- Dd brom nhạt dần rồi mất màu :
\(SO_2+Br_2+2H_2O\rightarrow H_2SO_4+2HBr\)
- Xuất hiện kết tủa trắng :
\(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
Nêu hiện tượng xảy ra trong các trường hợp sau và viết phương trình hóa học giải thích:
a) Dẫn khí Cl2 vào dung dịch NaOH (vừa đủ) ở nhiệt độ thường. Nhỏ vài giọt dung dịch thu được vào mẩu giấy quì tím.
b) Nhỏ từ từ đến dư dung dịch NaOH vào dung dịch AlCl3.
c) Đốt quặng FeS2 trong O2 dư và hấp thụ sản phẩm khí thu được bằng dung dịch Br2.
Phương pháp làm bài tập giải thích hiện tượng
Bước 1: dự đoán các PTHH có thể xảy ra
Bước 2: tập trung vào màu sắc, mùi của kết tủa, bay hơi, dung dịch sau phản ứng.
a) Cl2 + 2NaOH → NaCl + NaClO
NaClO có tính tẩy màu nên khi nhỏ vài giọt dung dịch vào quì tím ta thấy quì tím mất màu.
b) 3NaOH + AlCl3 → 3NaCl + Al(OH)3↓
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Lúc đầu: ta thấy dung dịch xuất hiện kết tủa trắng, dạng keo.
Sau đó: kết tủa tăng dần đến tối đa, sau đó thêm tiếp NaOH dư vào thì thấy kết tủa dần bị hòa tan đến khi hoàn toàn. Dung dịch trở lại trong suốt.
c) 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Khí thu được là SO2 có khả năng làm mất màu dung dịch Br2
chia hỗn hợp A gồm CH4 và C2H4 có khối lượng 3,2 gam thành hai phần không bằng nhau . Phần 1 : hấp thụ hết vào bình chứa dung dịch brom dư, sau phản ứng đã có 3,2 gam brom tham gia phản ứng. Phần 2: đốt cháy hoàn toàn trong khí oxi, rồi dẫn toàn bộ sản phẩm cháy vào dung dịch Ba(OH)2 dư thu được 32,505 gam kết tủa. a) viết các phản ứng xảy ra b) tính khối lượng CH4 trong A
Bài 18: X là hỗn hợp gồm metan và etylen. Dẫn X qua bình nước brom dư thấy có 8 gam brom tham gia phản ứng. Khí thoát ra khỏi bình đem đốt cháy hoàn toàn rồi hấp thụ toàn bộ sản phẩm cháy vào bình nước vôi trong thấy có 15 gam kết tủa.
a/ Viết các phương trình phản ứng xảy ra
b/ Tính % thể tích các chất trong X.
cho mk xin gấp đáp án vs ạkTT
a)
$C_2H_4 + Br_2 \to C_2H_4Br_2$
$CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O$
$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
b) Theo PTHH :
$n_{C_2H_4} = n_{Br_2} = \dfrac{8}{160} = 0,05(mol)$
$n_{CH_4} = n_{CaCO_3} = \dfrac{15}{100} = 0,15(mol)$
$\%V_{C_2H_4} = \dfrac{0,05}{0,05 + 0,15}.100\% = 25\%$
$\%V_{CH_4} = 100\% - 25\% = 75\%$
Đốt cháy hoàn toàn m gam quặng pirit sắt (chứa 80% FeS2 về khối lượng, còn lại là tạp chất trơ) bằng một lượng oxi dư. Lấy toàn bộ lượng SO2 thu được cho hấp thụ hết vào 100ml dung dịch X chứa Ba(OH)2 1,5M và NaOH 1M thì thu được 26,04 gam kết tủa. Giá trị lớn nhất của m là
A. 13,44
B. 18,99
C. 16,80
D. 21,00
Đáp án C
![]()
Vì ![]() nên chỉ có hai trường hợp là SO2 thiếu hoặc phản ứng tạo hai muối. Đề bài yêu cầu tìm giá trị lớn nhất của m nên khi cho SO2 vào dung dịch X sẽ tạo hai muối
H
S
O
-
3
và
S
O
2
-
3
nên chỉ có hai trường hợp là SO2 thiếu hoặc phản ứng tạo hai muối. Đề bài yêu cầu tìm giá trị lớn nhất của m nên khi cho SO2 vào dung dịch X sẽ tạo hai muối
H
S
O
-
3
và
S
O
2
-
3
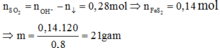
Đốt cháy hoàn toàn m gam quặng pirit sắt (chứa 80% FeS2 về khối lượng, còn lại là tạp chất trơ) bằng một lượng oxi dư. Lấy toàn bộ lượng SO2 thu được cho hấp thụ hết vào 100ml dung dịch X chứa Ba(OH)2 1,5M và NaOH 1M thì thu được 26,04 gam kết tủa. Giá trị lớn nhất của m là:
A. 13,44
B. 18,99
C. 16,80
D. 21,00
Đáp án C
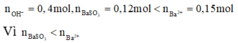
nên chỉ có hai trường hợp là SO2 thiếu hoặc phản ứng tạo hai muối. Đề bài yêu cầu tìm giá trị lớn nhất của m nên khi cho SO2 vào dung dịch

Hỗn hợp khí A gồm 3 hiđrocacbon mạch hở X, Y, Z trong đó Y, Z thuộc cùng dãy đồng đẳng. Cho 0,035 mol A lội qua bình đựng dung dịch brom dư thì khối lượng của bình tăng 0,56 gam và có 0,01 mol brom phản ứng. Hỗn hợp khí không bị hấp thụ đem đốt cháy hoàn toàn cần dùng 0,7 mol không khí (chứa 20% oxi), hấp thụ hết sản phẩm cháy vào nước vôi trong dư, xuất hiện 0,085 mol kết tủa đồng thời khối lượng bình tăng a gam. Công thức phân tử của X và giá trị của a lần lượt là
A. C3H6 và 2,78
B. C3H6 và 5,72
C. C4H8 và 2,78
D. C4H8 và 5,72
Đốt cháy m gam hỗn hợp gồm vinyl fomat, axit axetic, tinh bột bằng lượng oxi dư. Sau khi các phản ứng xảy ra hoàn toàn, cho hấp thụ hết toàn bộ sản phẩm cháy vào bình đựng dung dịch Ba(OH)2 dư, sau phản ứng thấy tách ra 92,59 gam kết tủa, đồng thời khối lượng dung dịch còn lại giảm 65,07 gam so với dung dịch ban đầu. Giá trị của m gần nhất với giá trị nào sau đây?
A. 17,0
B. 10,0
C. 14,5
D. 12,5
Nhận thấy các chất trong hỗn hợp đều có dạng Cm(H2O)n nên có thể quy về C và H2O.
Đốt cháy hỗn hợp thu được sản phẩm dẫn vào Ba(OH)2 dư thu được kết tủa là BaCO3 0,47 mol nên C 0,47 mol.
Khối lượng dung dịch giảm 65,07 gam.
\(\rightarrow mH_2O=92,59-65,07-0,47.44=6,84\left(g\right)\)
\(\rightarrow m=6,84+0,47.12=12,48\left(g\right)\)
=> chọn D
nCO2 = nBaCO3 = 0,47 mol => nC = 0,47 mol
m dung dịch giảm = mBaCO3 – mCO2 – mH2O
=> 65,07 = 92,59 – 0,47.44 – mH2O
=> mH2O = 6,84 gam => nH2O = 0,38 mol => nH = 0,76 mol
CTPT các chất lần lượt là: C3H4O2, C2H4O2, C6H10O5
=> nO = n\(\dfrac{H}{2}\) = 0,38 mol
->m = mC + mH + mO = 0,47.12 + 0,76 + 0,38.16 = 12,48 gam