Để đốt cháy hoàn toàn khí metan(CH⁴) trong không khí thu được 3,36 lít khí CO² ở đktc a.tính VCH⁴ b.VO² và Vkk cần gắp ạ
Bài 42. Luyện tập chương IV
\(a.n_{CO_2}=\dfrac{3,36}{22,4}=0,15mol\\ CH_4+2O_2\xrightarrow[]{t^0}CO_2+2H_2O\\ n_{CH_4}=n_{CO_2}=0,15mol\\ V_{CH_4}=0,15.22,4=3,36l\\ b.n_{O_2}=2n_{CO_2}=0,3mol\\ V_{O_2}=0,3.22,4=6,72l\\ V_{KK}=6,72:\dfrac{1}{5}=33,6l\)
Đúng 2
Bình luận (0)
a) Gọi CTPT chung của A là \(C_xH_y\)
\(n_{CO_2}=\dfrac{2,64}{44}=0,06mol\\ \Rightarrow m_C=12.0,06=0,72g\\ n_{H_2O}=\dfrac{1,44}{18}=0,08mol\\ \Rightarrow m_H=2.0,08=0,16g\\ n_X=\dfrac{0,448}{22,4}=0,02mol\\ m_X=0,02.44=0,88g\)
Ta có tỉ lệ
\(\dfrac{12x}{0,72}=\dfrac{y}{0,16}=\dfrac{44}{0,88}\\ \Rightarrow x=3;y=8\)
Vậy CTPT của A là \(C_3H_8\)
\(b)CTCT:CH_3-CH_2-CH_3\\ PỨĐT:\)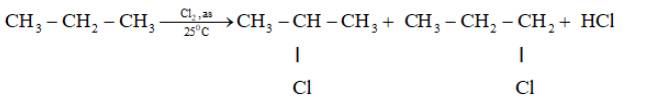
Đúng 1
Bình luận (1)
Câu 3: Đốt cháy hoàn toàn 6,72 lít (đktc) hỗn hợp khí metan và axetilen thu được 11,2 lít (đktc) khí C*O_{2}
a. Xác định % về thể tích của metan và axetilen
b. Xác định khối lượng dung dịch Brom có thể tác dụng hoàn toàn với hỗn hợp khí trên.
Đốt cháy 3 g chất hữu cơ A (C,H,O)cần vừa đủ 7,2 g . Khí O2 cho toàn bộ sản phẩm thu được vào dd (eCOH)2 dư . Thấy tạo ra 15g kết tủa . Xác định công thức phân tử A. Biết 1 lít A nặng gấp 2 lần 1 lít (2Hg ở cùng đ/c)
phân tử hợp chất hữu cớ A có 2 ng tố. Khi đót cháy 4,8g chất A thu được 6,72l khí CO2 (đktc). Hãy xác định công thức phân tử của A, biết khối lượng mol của A là 16g/ mol
\(BTNTC:n_C=n_{CO2}=\dfrac{6,72}{22,4}=0,3\rightarrow m_C=0,3.12=3,6< m_A\)
---> A chứa 2 nguyên tố C , H
\(m_H=m_A-m_C=4,8-3,6=1,2\left(g\right)\)
Đặt CT : \(C_xH_y\)
\(x:y=\dfrac{m_C}{12}=\dfrac{m_H}{1}=\dfrac{3,6}{12}:\dfrac{1,2}{1}=1:4\)
\(\rightarrow CTTQ:\left(CH_4\right)_n\)
\(\rightarrow12+4n=16\rightarrow n=1\)
\(\rightarrow CTPT:CH_4\)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 784 ml khí (đktc) một hidrocacbon A thu được 1,54 gam 𝐶𝑂2 và 1,89 gam nước. Xác định công thức phân tử và công thức cấu tạo của A. Biết A có mạnh cacbon hở và làm mất màu dung dịch brom. Viết PTHH của phản ứng xảy ra.
Đọc tiếp
Đốt cháy hoàn toàn 784 ml khí (đktc) một hidrocacbon A thu được 1,54 gam 𝐶𝑂2 và 1,89 gam nước. Xác định công thức phân tử và công thức cấu tạo của A. Biết A có mạnh cacbon hở và làm mất màu dung dịch brom. Viết PTHH của phản ứng xảy ra.
\(n_A=\dfrac{0,784}{22,4}=0,035\left(mol\right)\)
\(n_{CO_2}=\dfrac{1,54}{44}=0,035\left(mol\right)\\ n_{H_2O}=\dfrac{1,89}{18}=0,105\left(mol\right)\)
Có: \(n_{CO_2}< n_{H_2O}\Leftrightarrow A:ankan\left(C_nH_{2n+2}\right)\)
\(n=\dfrac{0,035}{0,035}=1\Rightarrow CTPT.A:CH_4\)
PTHH:
\(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(CH_4+Br_2\underrightarrow{t^o}CH_3Br+HBr\)
Đúng 2
Bình luận (0)
\(n_{O_2}=\dfrac{0,784}{22,4}=0,035\left(mol\right)\\ n_C=n_{CO_2}=\dfrac{1,54}{44}=0,035\left(mol\right);n_H=2.n_{H_2O}=2.\dfrac{1,89}{18}=0,21\left(mol\right)\\ Gọi.CTTQ:C_xH_y\left(x,y;nguyên,dương\right)\\ Có:x:y=0,035:0,21=1:6\Rightarrow x=1;y=6\Rightarrow CTPT:CH_6\)
Nếu CTPT CH6 thì không có, em xem lại đề giúp thầy nhé!
Đúng 0
Bình luận (0)
Mn giải hộ mik bài này vs ạ, theo kiểu biện luận Cho hỗn hợp Y gồm 2,8g Fe và 0,81 Al vào 200ml dung dịch C chứa AgNO3 và Cu(NO3)2. Khi phản ứng kết thúc thu được dung dịch D và 8,12g chất rắn E gồm 3 kim loại. Cho rắn E tác dụng với HCl dư thì thu được 0,672l H2 (đktc). Tính Cm của AgNO3 và Cu(NO3)2 trong dung dịch C.
Ta có: \(n_{Fe}=\dfrac{2,8}{56}=0,05\left(mol\right)\)
\(n_{Al}=\dfrac{0,81}{27}=0,03\left(mol\right)\)
- E gồm: Ag, Cu và Fe dư.
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{Fe\left(dư\right)}=n_{H_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\) ⇒ nFe pư = 0,05 - 0,03 = 0,02 (mol)
⇒ mAg + mCu = 8,12 - 0,03.56 = 6,44 (g)
Gọi: \(\left\{{}\begin{matrix}n_{AgNO_3}=x\left(mol\right)\\n_{Cu\left(NO_3\right)_2}=y\left(mol\right)\end{matrix}\right.\)
BTNT Ag: nAg = nAgNO3 = x (mol)
BTNT Cu: nCu = nCu(NO3)2 = y (mol)
⇒ 108x + 64y = 6,44 (1)
Theo ĐLBT e, có: 2nFe pư + 3nAl = nAg+ + 2nCu2+ ⇒ nAg + 2nCu = 0,13 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,03\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{AgNO_3}}=\dfrac{0,03}{0,2}=0,15\left(M\right)\\C_{M_{Cu\left(NO_3\right)_2}}=\dfrac{0,05}{0,2}=0,25\left(M\right)\end{matrix}\right.\)
Đúng 3
Bình luận (0)
Hòa tan hoàn toàn 2,4 gam Mg vào đúng dịch CH3COOH tính thể tích khí H2 thoát ra (ở đkt) biết Mg=24,H=1,C=12,O=16.
\(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
PT: \(Mg+2CH_3COOH\rightarrow\left(CH_3COO\right)_2Mg+H_2\)
Theo PT: \(n_{H_2}=n_{Mg}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
Đúng 3
Bình luận (0)
Trình bày phương pháp hóa học hãy nhận biết các: C2H4, HCl, CO2, CH4
- Dẫn từng khí qua quỳ tím ẩm.
+ Quỳ tím hóa đỏ: HCl, CO2. (1)
PT: \(CO_2+H_2O⇌H_2CO_3\)
+ Quỳ tím không đổi màu: C2H4, CH4. (2)
- Dẫn khí nhóm (1) qua dd Ca(OH)2 dư.
+ Xuất hiện kết tủa trắng: CO2.
PT: \(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_{3\downarrow}+H_2O\)
+ Không hiện tượng: HCl.
PT: \(Ca\left(OH\right)_2+2HCl\rightarrow CaCl_2+2H_2O\)
- Dẫn khí nhóm (2) qua dd Brom dư.
+ Dd Brom nhạt màu dần: C2H4.
PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
+ Không hiện tượng: CH4
Đúng 1
Bình luận (0)
Bài tập 1: dẫn 3.36l hỗn hợp khí CH4, C2H4 vào dd Br dư. Sau phản ứng có 8g Br đã phản ứng, tính thể tích mỗi khí trong hỗn hợp.Bài tập 2: 1 hỗn hợp C2H2, C2H4 có thể tích khí 5,6l ở ĐKTC, cho qua dd Br dư, dd này nặng thêm 6,8g. Tích thể tích mỗi khí trong hỗn hợp ban đầu.Mong mn trả lời nhanh giúp mình trước 10h ngày mai
Đọc tiếp
Bài tập 1: dẫn 3.36l hỗn hợp khí CH4, C2H4 vào dd Br dư. Sau phản ứng có 8g Br đã phản ứng, tính thể tích mỗi khí trong hỗn hợp.
Bài tập 2: 1 hỗn hợp C2H2, C2H4 có thể tích khí 5,6l ở ĐKTC, cho qua dd Br dư, dd này nặng thêm 6,8g. Tích thể tích mỗi khí trong hỗn hợp ban đầu.
Mong mn trả lời nhanh giúp mình trước 10h ngày mai
Bài 1:
\(n_{Br_2}=\dfrac{8}{160}=0,05\left(mol\right)\)
PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Theo PT: \(n_{C_2H_4}=n_{Br_2}=0,05\left(mol\right)\)
\(\Rightarrow V_{C_2H_4}=0,05.22,4=1,12\left(l\right)\)
\(\Rightarrow V_{CH_4}=3,36-1,12=2,24\left(l\right)\)
Đúng 1
Bình luận (0)
Bài 2:
Ta có: \(n_{C_2H_2}+n_{C_2H_4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\left(1\right)\)
m dd tăng = mC2H2 + mC2H4
\(\Rightarrow6,8=26n_{C_2H_2}+28n_{C_2H_4}\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{C_2H_2}=0,1\left(mol\right)\\n_{C_2H_4}=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}V_{C_2H_2}=0,1.22,4=2,24\left(l\right)\\V_{C_2H_4}=0,15.22,4=3,36\left(l\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)






