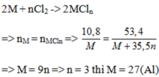Cho a g Kim loại R tác dung hoàn toàn vói khí Cl2 thu được 2,9018.a g muối clorua.Tìm R
NB
Những câu hỏi liên quan
Kim loại R hòa tan hết trong dung dịch HCl được 25,4g muối khan. Cũng lượng kim loại trên tác dụng với khí Cl2 dư thu được 32,5 g muối . Kim loại R là
Cho 10,8g một kim loại R có hoá trị III tác dụng với khí cl2 dư thu đc 53,4 g muối. Xác định kim loại R.
$2R + 3Cl_2 \xrightarrow{t^o} 2RCl_3$
Theo PTHH :
$n_R = n_{RCl_3} \Rightarrow \dfrac{10,8}{R} = \dfrac{53,4}{R + 35,5.3}$
$\Rightarrow R = 27(Al)$
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn m gam kim loại M trong bình chứa Cl2 dư sản phẩm sinh ra là muối clorua của kom loại M và lượng khí cl2 giảm đi 6.72 lít (đktc).cho toàn bộ muối sinh ra tác dụng với dung dịch NaOH dư thì thu đc 21.4 g kết tủa hiđro oxit của kim loại M ( là hợp chất của M và nhóm OH) tìm kim loại M
Giả sử M có hóa trị n.
PT: \(2M+nCl_2\underrightarrow{t^o}2MCl_n\)
\(MCl_n+nNaOH\rightarrow M\left(OH\right)_{n\downarrow}+nNaCl\)
Ta có: \(n_{Cl_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{MCl_n}=\dfrac{2}{n}n_{Cl_2}=\dfrac{0,6}{n}\left(mol\right)\)
\(n_{M\left(OH\right)_n}=\dfrac{21,4}{M_M+17n}\left(mol\right)\)
Theo PT: \(n_{MCl_n}=n_{M\left(OH\right)_n}\Rightarrow\dfrac{0,6}{n}=\dfrac{21,4}{M_M+17n}\)
\(\Rightarrow M_M=\dfrac{56}{3}n\left(g/mol\right)\)
Với n = 3 thì MM = 56 (g/mol) là tm.
Vậy: M là Fe.
Đúng 1
Bình luận (0)
Nhiệt phân hoàn toàn 7,26 gam muối nitrat của kim loại R hóa trị III, sau phản ứng thu được 2,4 gam oxit kim loại và hỗn hợp khí A.
a) Xác định kim loại R.
b) Hấp thụ toàn bộ khí A vào 100 ml H2O thu được dung dịch B. Tính pH của dung dịch B ?
Đốt cháy hoàn toàn 10,8 g kim loại R có 1 hóa trị duy nhất tạo ra 20,4 g oxit của kim loại đó .
a) Xác đinh kl R (mik lm dc roi nhé là Al)
b) Nếu điện phân nóng chảy và có mặt chất xúc tác toàn bộ lượng axit trên sẽ thu được a g kim loại R và V lít khí O2 (dktc). Hãy lập luận cách tìm ra a và V 1 cách nhanh nhất
Ta có 2 PTHH:
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\left(1\right)\)
\(2Al_2O_3\underrightarrow{\text{điện phân nóng chảy}}4Al+3O_2\left(2\right)\)
ĐLBTKL (1): \(m_{Al}+m_{O_2}=m_{Al_2O_3}\)
ĐLBTKL (2): \(m_{Al_2O_3}=m_{Al}+m_{O_2}\)
\(\rightarrow\left\{{}\begin{matrix}V_{O_2}=\dfrac{20,4-10,8}{32}.22,4=6,72\left(l\right)\\m_{Al}=10,8\left(g\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Cho 10,8 gam kim loại M tác dụng hoàn toàn với khí Cl2 dư thu được 53,4 gam muối clorua. Kim loại M là
A. Mg
B. Al
C. Fe
D. Zn
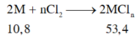
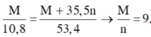
=> kim loại là Al (M=27; n=3)
Đáp án B
Đúng 0
Bình luận (0)
Cho 10,8 gam kim loại M tác dụng hoàn toàn với khí Cl2 dư thu được 53,4 gam muối clorua. Kim loại M là
A. Mg
B. Al
C. Fe
D. Zn
Đáp án B
Gọi n là hóa trị của M.
2M + nCl2 → 2MCln
Theo pt, nM = nmuối =>![]() => M = 9n
=> M = 9n
n = 1 => M = 9 (loại)
n = 2 => M = 18 (loại)
n = 3 => M = 27 (Al)
Đúng 0
Bình luận (0)
Cho 10,8 gam kim loại M tác dụng hoàn toàn với khí Cl2 dư thu được 53,4 gam muối clorua. Kim loại M là
A. Mg
B. Al
C. Fe
D. Zn
Đề: A là hỗn hợp gồm R2CO3, RHCO3, RCl.(Biết R là kim loại hóa trị I). Cho 43,71 gam hỗn hợp A tác dụng hết với V ml dung dịch HCl 10,95% (D 1,2 g/ml) lấy dư thu được dung dịch B và 17,6 gam khí C. Chia dung dịch B thành 2 phần bằng nhau:- Phần 1: Phản ứng vừa đủ với 125 ml dung dịch KOH 0,8M. Cô cạn dung dịch thu được m gam muối khan.- Phần 2: Tác dụng hoàn toàn với dung dịch AgNO3 dư thu được 68,88 gam kết tủa trắng.1. Xác định tên kim loại R và phần trăm khối lượng mỗi chất trong A.2. Tìm m...
Đọc tiếp
Đề: A là hỗn hợp gồm R2CO3, RHCO3, RCl.(Biết R là kim loại hóa trị I). Cho 43,71 gam hỗn hợp A tác dụng hết với V ml dung dịch HCl 10,95% (D = 1,2 g/ml) lấy dư thu được dung dịch B và 17,6 gam khí C. Chia dung dịch B thành 2 phần bằng nhau:
- Phần 1: Phản ứng vừa đủ với 125 ml dung dịch KOH 0,8M. Cô cạn dung dịch thu được m gam muối khan.
- Phần 2: Tác dụng hoàn toàn với dung dịch AgNO3 dư thu được 68,88 gam kết tủa trắng.
1. Xác định tên kim loại R và phần trăm khối lượng mỗi chất trong A.
2. Tìm m và V.
đùa nhau à.cái này mà là toán lớp 1 hả
nani??????????????????? troll ak man
gọi số mol của hỗn hợp muối là ⎧⎩⎨X2CO3:2xXHCO3:2yXCl:2z
gọi số mol HCl : a mol
ptpu : X2CO3 + 2HCl = 2XCl + CO2 + H2O
XHCO3 + HCl = XCl + CO2 + H2O
khí B : CO2 có số mol = 0,4 mol = 2x + 2y (1)
dd A gồm : {XCl:2(2x+y+z)HCldư=a−4x−2y
Phần 1 : hh A + AgCl = kết tủa
kết tủa ở đây chính là AgCl => số mol AgCl = 0,48 mol
=> z + a2
=0,48 => a = (0,48 -z) / 2 (2)
Phần 2 : nKOH = 0,1 = 12
nHCl dư => a -4x -2y = 0,2 (3)
hốn hợp muối gồm : {XCl:2x+y+zKCl:0,1
m hỗn hợp muối = 29,68 = (2x + y+z) .(X+35,5) = 29,68 -39.0,1 = 22,23 (4)
từ (2) thay vào (3) => (2x + y +z) = 0,38 (5)
từ (5) thay vào (4) ta tìm được X = 23 => X là Na
Đến đây bạn tự giải câu b nhé
Xem thêm câu trả lời