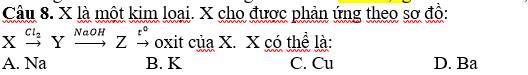Bài 2. Một số oxit quan trọng
a, \(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
b, Gọi: \(\left\{{}\begin{matrix}n_{CuO}=x\left(mol\right)\\n_{Fe_2O_3}=y\left(mol\right)\end{matrix}\right.\) ⇒ 80x + 160y = 32 (1)
Theo PT: \(\left\{{}\begin{matrix}n_{CuCl_2}=n_{Cu}=x\left(mol\right)\\n_{FeCl_3}=2n_{Fe_2O_3}=2y\left(mol\right)\end{matrix}\right.\) ⇒ 135x + 325y = 59,5 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{CuO}=0,2.80=16\left(g\right)\\m_{Fe_2O_3}=0,1.160=16\left(g\right)\end{matrix}\right.\)
c, Theo PT: \(n_{HCl}=2n_{CuO}+6n_{Fe_2O_3}=1\left(mol\right)\)
\(\Rightarrow V_{ddHCl}=\dfrac{1}{0,5}=2\left(l\right)\)
Đúng 2
Bình luận (0)
Cho 3,36l hỗn hợp CO2 và SO2 ( đktc) tác dụng với Ca(OH)2 thu được 17g kết tủa
a) Tính% thể tích các chất trong Ab)Xác định tỉ khối của A so với khí Hea, \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_{3\downarrow}+H_2O\)
\(SO_2+Ca\left(OH\right)_2\rightarrow CaSO_{3\downarrow}+H_2O\)
Gọi: \(\left\{{}\begin{matrix}n_{CO_2}=x\left(mol\right)\\n_{SO_2}=y\left(mol\right)\end{matrix}\right.\) \(\Rightarrow x+y=\dfrac{3,36}{22,4}=0,15\left(mol\right)\left(1\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{CaCO_3}=n_{CO_2}=x\left(mol\right)\\n_{CaSO_3}=n_{SO_2}=y\left(mol\right)\end{matrix}\right.\) ⇒ 100x + 120y =17 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,05\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CO_2}=\dfrac{0,05.22,4}{3,36}.100\%\approx33,33\%\\\%V_{SO_2}\approx66,67\%\end{matrix}\right.\)
b, \(d_{A/He}=\dfrac{\dfrac{0,05.44+0,1.64}{0,15}}{4}\approx14,33\)
Đúng 3
Bình luận (0)
cho 8 (g) Fe₂O₃ tác dụng với 150 (g) dd axit sunfuric có nồng độ 20% Tính nồng độ % các chất có trong dd sau phản ứng
$n_{Fe_2O_3} = 0,05(mol)$
$n_{H_2SO_4} = \dfrac{150.20\%}{98} = \dfrac{15}{49}(mol)$
$Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O$
Ta thấy :
$n_{Fe_2O_3} : 1 < n_{H_2SO_4} :3$ nên $H_2SO_4$ dư
$m_{dd\ sau\ pư} = 8 + 150 = 158(gam)$
$n_{H_2SO_4\ dư} = \dfrac{15}{49} - 0,05.3 = \dfrac{153}{980}(mol)$
$n_{Fe_2(SO_4)_3} = 0,025(mol)$
$C\%_{H_2SO_4} = \dfrac{ \dfrac{153}{980}.98}{158} .100\% = 9,7\%$
$C\%_{Fe_2(SO_4)_3} = \dfrac{0,025.400}{158}.100\% = 6,3\%$
Đúng 1
Bình luận (0)
\(Cu+Cl_2\xrightarrow[]{t^o}CuCl_2\)
\(CuCl_2+2NaOH\xrightarrow[]{}Cu\left(OH\right)_2+2NaCl\)
\(Cu\left(OH\right)_2\xrightarrow[]{t^o}CuO+H_2O\)
Chọn C
Đúng 1
Bình luận (0)
Giúp e với mn ơi. E đang cần gasp
Đúng 0
Bình luận (0)
Giải hộ mik bài 2, cần gấp nhanh ạ
phân loại và gọi tên các oxit sau: CuO , ZnO , BaO , H2O , N2O5 , Fe2O3 , Ag2O, NO2, PbO , SO3 ,CO2 , N2O3 , K2O , MgO, HgO , CaO, FeO, P2O5, Al2O3, Cu2O,Fe3O4 .
cho 200ml đe nạo 1M tác dụng 200ml đe H2so4
Nhận biêtz 2 chất rắn mất nhãn Na2O,MgO
Trích mẫu thử.
Hoà 2 mẫu thử trên vào nước.
- Nếu mẫu thử nào tan, toả nhiệt thì là Na2O:
\(Na_2O+H_2O\rightarrow2NaOH\)
- Còn MgO không tan.
Dán lại nhãn cho 2 lọ chất rắn trên.
Đúng 2
Bình luận (0)
- Trích mỗi chất một ít làm mẫu thử. Đánh số thứ tự ở ống nghiệm cũng như lọ hoá chất tương ứng.
- Dùng quỳ tím ẩm đặt vào 2 chất rắn. Nếu quỳ tím hoá xanh thì đó là Na2O. Còn MgO không làm quỳ tím ẩm đổi màu.
\(PTHH:Na_2O+H_2O\rightarrow2NaOH\)
Đúng 1
Bình luận (0)
trong các oxde này: CaO,Fe2O3,SO3,ZnO,CuO,NO,Na2O,CO2,P2O5,SO2,BaO,CO,K2O,MgO,Al2O3, oxide nào tác dụng với các chất sau.
Hãy viết PTHH xảy ra
a. H2O
b.Ca(OH)2
c.HCL
d.CO2
e.Na2O