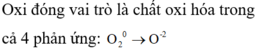-> 1/2N2+1/2O2--->NO.ΔrH298=+90,3kj.nhiệt tạo thành chuẩn của NO là
98o1
HV
Những câu hỏi liên quan
Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ΔrH298
o = -890,3 kJ
Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là –393,5 và –285,8 kJ/mol. Hãy tính
nhiệt tạo thành chuẩn của khí methane.
\(\Delta_fH^{^{ }o}_{298}\left[CH_4\right]=-\left(-890,3-\left(-393,5\right)-\left(-285,8\right)\right)\\ \Delta_fH^{^{ }o}_{298}\left[CH_4\right]=211kJ\cdot mol^{-1}\)
Đúng 1
Bình luận (0)
Cho các phản ứng:
(
1
)
C
+
O
2
→
C
O
2
(
2
)
2
C
u
+
O
2
→
2
C
u
O
(
3
)
4
N
H
3
+
3
O
2
→
2
N
2
+
6
H
2...
Đọc tiếp
Cho các phản ứng:
( 1 ) C + O 2 → C O 2 ( 2 ) 2 C u + O 2 → 2 C u O ( 3 ) 4 N H 3 + 3 O 2 → 2 N 2 + 6 H 2 O ( 4 ) 3 F e + 2 O 2 → F e 3 O 4
Trong phản ứng nào, oxi đóng vai trò chất oxi hóa
A. Chỉ có phản ứng (1).
B. Chỉ có phản ứng (2).
C. Chỉ có phản ứng (3).
D. Cả 4 phản ứng.
3/ Tính nhiệt tạo thành của etan biết:Cgr + O2 CO2 DH0298 -393,5 kJH2 + 1/2O2 H2O(l) DH0298 -285 kJ2C2H6 + 7O2 4 CO2 + H2O(l) DH0298 -3119,6 kJ
Đọc tiếp
3/ Tính nhiệt tạo thành của etan biết:
Cgr + O2 = CO2 DH0298 = -393,5 kJ
H2 + 1/2O2 = H2O(l) DH0298 = -285 kJ
2C2H6 + 7O2 = 4 CO2 + H2O(l) DH0298 = -3119,6 kJ
Công thức tổng quát của este tạo bởi axit đơn chức, no, mạch hở và đồng đẳng benzen là
A. CnH2n-6O2
B. CnH2n-8O2
C. CnH2n-4O2
D. CnH2n-2O2
Xem thêm câu trả lời
Quá trình lên men rượu vang xảy ra phản ứng hóa học sauC6H12O6(s) ---- 2C2H5OH(1)+2CO2(g)a. Tính biến thiên enthalpy chuẩn của phản ứng theo nhiệt tạo thành chuẩn của các chất (biết nhiệt tạo thành chuẩn của C6H12O6(s) C2H5OH(l); CO2(g) có giá trị lần lượt là –1274kJ/mol: 277,69 kJ/mol 393,51kJ/molb, Tính lượng nhiệt tòa ra hay thu vào khi lên men 3 kg nhỏ (chứa khoảng 7% đường glucose) ở điều kiện chuẩn
Đọc tiếp
Quá trình lên men rượu vang xảy ra phản ứng hóa học sau
C6H12O6(s) ----> 2C2H5OH(1)+2CO2(g)
a. Tính biến thiên enthalpy chuẩn của phản ứng theo nhiệt tạo thành chuẩn của các chất (biết nhiệt tạo thành chuẩn của C6H12O6(s) C2H5OH(l); CO2(g) có giá trị lần lượt là –1274kJ/mol: 277,69 kJ/mol 393,51kJ/mol
b, Tính lượng nhiệt tòa ra hay thu vào khi lên men 3 kg nhỏ (chứa khoảng 7% đường glucose) ở điều kiện chuẩn
CnH2n-2O2 có thể là công thức tổng quát của mấy loại hợp chất trong số các hợp chất sau ? (1) axit cacboxylic không no có 1 nối đôi, đơn chức, mạch hở. (2) este không no, có 1 nối đôi, đơn chức, mạch hở. (3) Este no, hai chức mạch hở. (4) Anđehit no hai chức, mạch hở. (5) Ancol no, 2 chức, mạch hở A. 2 B. 3 C. 4 D. 5
Đọc tiếp
CnH2n-2O2 có thể là công thức tổng quát của mấy loại hợp chất trong số các hợp chất sau ?
(1) axit cacboxylic không no có 1 nối đôi, đơn chức, mạch hở.
(2) este không no, có 1 nối đôi, đơn chức, mạch hở.
(3) Este no, hai chức mạch hở.
(4) Anđehit no hai chức, mạch hở.
(5) Ancol no, 2 chức, mạch hở
A. 2
B. 3
C. 4
D. 5
12.Cho phảnứng:C6H12O6(r) + 6O2(k) 6CO2(k) + 6H2O (l)Cho biết các chất được lấyởtrạng thái chuẩn;sinh nhiệt chuẩn, 298Kcủa C6H12O6, CO2, H2O lần lượt là−304,6;−94,6 và−68,3 kcal/mol. Tính nhiệt lượng giảiphóng ra khi oxi hóa 36,0 g đường glucose..
13.TínhΔHocủa phảnứng đốt cháy methane:CH4(k)+ 2O2(k)àCO2(k)+ 2H2O(k)Cho biết :C(gr) + 2H2(k)àCH4(k) (1) cóΔHo298(1)−74,8 kJC(gr)+ O2(k)àCO2(k)(2) cóΔHo298(2)−393 kJH2(k) + ½ O2(k)àH2O(k) (3) cóΔHo298(3)−242 kJ
14.Cho biết:C(than chì)+ O2(k)àCO2(k)(...
Đọc tiếp
12.Cho phảnứng:C6H12O6(r) + 6O2(k) = 6CO2(k) + 6H2O (l)Cho biết các chất được lấyởtrạng thái chuẩn;sinh nhiệt chuẩn, 298Kcủa C6H12O6, CO2, H2O lần lượt là−304,6;−94,6 và−68,3 kcal/mol. Tính nhiệt lượng giảiphóng ra khi oxi hóa 36,0 g đường glucose..
13.TínhΔHocủa phảnứng đốt cháy methane:CH4(k)+ 2O2(k)àCO2(k)+ 2H2O(k)Cho biết :C(gr) + 2H2(k)àCH4(k) (1) cóΔHo298(1)=−74,8 kJC(gr)+ O2(k)àCO2(k)(2) cóΔHo298(2)=−393 kJH2(k) + ½ O2(k)àH2O(k) (3) cóΔHo298(3)=−242 kJ
14.Cho biết:C(than chì)+ O2(k)àCO2(k)(1)∆Ho298(1)=−393,5 kJ;H2(k)+ 1/2O2(k)àH2O(l)(2)∆Ho298(2)=−285,8 kJCH3OH(k)+ 3/2O2(k)àCO2(k)+ 2H2O(l)(3)∆Ho298(3)=−726,4 kJHãy tính sinh nhiệt chuẩn (∆Ho298,s) của CH3OH(k).
15.Tính sinh nhiệt tiêu chuẩn của CH3OH (l). Biết rằng sinh nhiệt tiêu chuẩn của CO2(k), H2O (l) lần lượtlà-94,05;-238,90(kcal/mol) và thiêu nhiệt tiêu chuẩn của CH3OH (l) là−173,78 kcal/mo
sao mn:))
Nhiệt tỏa ra khi hình thành 1 mol Na2O(s) ở điều kiện chuẩn từ phản ứng giữa Na(s) và O3(g) có được coi là nhiệt tạo thành chuẩn của Na2O(s) không? Giả sử Na tác dụng được với O3 thu được Na2O.
Nhiệt tỏa ra khi hình thành 1 mol Na2O(s) ở điều kiện chuẩn từ phản ứng giữa Na(s) và O3(g) không được coi là nhiệt tạo thành chuẩn của Na2O(s) vì oxygen dạng phân tử O3 (ozone) không là dạng bền nhất.
Đúng 0
Bình luận (0)
Câu 1. Sản phẩm nhiệt phân hoàn toàn muối Magie nitrat là
A. Mg(NO2)2, O2
B. MgO, NO2, O2
C. Mg, NO2, O2
D. MgO,NO2
Câu 2. Cho 13,44 lít khí NH3 (đktc) tác dụng với dung dịch AlCl3. Số gam kết tủa Al(OH)3 tạo thành là?
Câu 3. Phản ứng nào sau đây thể hiện tính khử của NH3?
A. 2NH3 + H2SO4 - (NH4)2SO4
B. 2NH3 + MgCl2 + 2H2O - Mg(OH)2 + 2NH4Cl
C. 4NH3 + 2O2 - 6H2O + 2N2
D. NH3 + H2O - NH4+ + OH-
Đọc tiếp
Câu 1. Sản phẩm nhiệt phân hoàn toàn muối Magie nitrat là
A. Mg(NO2)2, O2
B. MgO, NO2, O2
C. Mg, NO2, O2
D. MgO,NO2
Câu 2. Cho 13,44 lít khí NH3 (đktc) tác dụng với dung dịch AlCl3. Số gam kết tủa Al(OH)3 tạo thành là?
Câu 3. Phản ứng nào sau đây thể hiện tính khử của NH3?
A. 2NH3 + H2SO4 -> (NH4)2SO4
B. 2NH3 + MgCl2 + 2H2O -> Mg(OH)2 + 2NH4Cl
C. 4NH3 + 2O2 -> 6H2O + 2N2
D. NH3 + H2O -> NH4+ + OH-
Công thức tổng quát của este được tạo thành từ axit không no có 1 nối đôi, đơn chức và ancol no, đơn chức là A. CnH2n-1COOCmH2m+1 B. CnH2n-1COOCmH2m-1 C. CnH2n+1COOCmH2m-1 D. CnH2n+1COOCmH2m+1
Đọc tiếp
Công thức tổng quát của este được tạo thành từ axit không no có 1 nối đôi, đơn chức và ancol no, đơn chức là
A. CnH2n-1COOCmH2m+1
B. CnH2n-1COOCmH2m-1
C. CnH2n+1COOCmH2m-1
D. CnH2n+1COOCmH2m+1