thành phần phần trăm về khối lượng của các nguyên tố C,H,O trong :C6H12O6;C3H8O;C2H5OH
11
Những câu hỏi liên quan
tìm CTHH của hợp chất, biết:a/ khối lượng mol của hợp chất A là 142 gam,thành phần phần trăm theo khối lượng của các nguyên tố: 32,39%Na;22,54%S;45,07%Ob/ khối lượng mol của hợp chất B là 123 gam, thành phần phần trăm theo khối lượng của các nguyên tố: 58,5%C;4,1%H;11,4%N;26%Oc/ hợp chất C có khối lượng mol nặng gấp 23 lần khí hidro, thành phần phần trăm theo khối lượng của các nguyên tố: 52,17%C; 13,05%H; 34,74%O
Đọc tiếp
tìm CTHH của hợp chất, biết:
a/ khối lượng mol của hợp chất A là 142 gam,thành phần phần trăm theo khối lượng của các nguyên tố: 32,39%Na;22,54%S;45,07%O
b/ khối lượng mol của hợp chất B là 123 gam, thành phần phần trăm theo khối lượng của các nguyên tố: 58,5%C;4,1%H;11,4%N;26%O
c/ hợp chất C có khối lượng mol nặng gấp 23 lần khí hidro, thành phần phần trăm theo khối lượng của các nguyên tố: 52,17%C; 13,05%H; 34,74%O
a)
-Đặt công thức: NaxSyOz
x=\(\dfrac{32,29.142}{23.100}\approx2\)
y=\(\dfrac{22,54.142}{32.100}\approx1\)
z=\(\dfrac{45,07.142}{16.100}\approx4\)
-CTHH: Na2SO4
Đúng 1
Bình luận (0)
Câu b này mình giải cách khác câu a:
nC:nH:nN:nO=\(\dfrac{\%C}{12}:\dfrac{\%H}{1}:\dfrac{\%N}{14}:\dfrac{\%O}{16}=\dfrac{58,5}{12}:\dfrac{4,1}{1}:\dfrac{11,4}{14}:\dfrac{26}{16}\)
nC:nH:nN:nO=4,875:4,1:0,81:1,625=6:5:1:2
-Công thức nguyên: (C6H5NO2)n
-Ta có: (12.6+5+14+16.2)n=123\(\Leftrightarrow\)123n=123\(\Leftrightarrow\)n=1
-CTHH: C6H5NO2
Đúng 1
Bình luận (0)
Câu c:
\(M_C=23.2=46đvC\)
nC:nH:nO=\(\dfrac{\%C}{12}:\dfrac{\%H}{1}:\dfrac{\%O}{16}=\dfrac{52,17}{12}:\dfrac{13,05}{1}:\dfrac{34,74}{16}\)
nC:nH:nO=4,3475:13,05:2,17125\(\approx\)2:6:1
-Công thức nguyên: (C2H6O)n
-Ta có: (12.2+6+16)n=46\(\Leftrightarrow\)46n=46\(\Leftrightarrow\)n=1
-CTHH: C2H6O
Đúng 1
Bình luận (0)
Câu 1: Thành phần phần trăm về khối lượng của nguyên tố Fe trong hợp chất Fe3O4 là:A. 72,4%B. 68,8%C. 76%D. 62,5%Câu 2: Hợp chất X có khối lượng mol phân tử là 232 g/mol, thành phần phần trăm khối lượng của Fe là 72,41%, còn lại là của O. Công thức hóa học của X làA. Fe3O4.B. FeO.C. Fe3O2.D. Fe2O3.Câu 3: Trong 1 mol phân tử FeCl3 có bao nhiêu gam nguyên tử clo?A. 71,0 gam.B. 35,5 gam.C. 142,0 gamD. 106,5 gam.Câu 4: Có bao nhiêu mol nguyên tử O trong 1 mol phân tử N2O5?A. 2 mol.B. 4 mol.C. 5 mo...
Đọc tiếp
Câu 1: Thành phần phần trăm về khối lượng của nguyên tố Fe trong hợp chất Fe3O4 là:
A. 72,4%
B. 68,8%
C. 76%
D. 62,5%
Câu 2: Hợp chất X có khối lượng mol phân tử là 232 g/mol, thành phần phần trăm khối lượng của Fe là 72,41%, còn lại là của O. Công thức hóa học của X là
A. Fe3O4.
B. FeO.
C. Fe3O2.
D. Fe2O3.
Câu 3: Trong 1 mol phân tử FeCl3 có bao nhiêu gam nguyên tử clo?
A. 71,0 gam.
B. 35,5 gam.
C. 142,0 gam
D. 106,5 gam.
Câu 4: Có bao nhiêu mol nguyên tử O trong 1 mol phân tử N2O5?
A. 2 mol.
B. 4 mol.
C. 5 mol.
D. 3 mol.
Câu 5: Khối lượng của Fe trong 92,8 g Fe3O4 là
A. 25,6 g.
B. 67,2 g.
C. 80 g.
D. 10 g.
Câu 1: Thành phần phần trăm về khối lượng của nguyên tố Fe trong hợp chất Fe3O4 là:
A. 72,4%
B. 68,8%
C. 76%
D. 62,5%
Câu 2: Hợp chất X có khối lượng mol phân tử là 232 g/mol, thành phần phần trăm khối lượng của Fe là 72,41%, còn lại là của O. Công thức hóa học của X là
A. Fe3O4.
B. FeO.
C. Fe3O2.
D. Fe2O3.
Câu 3: Trong 1 mol phân tử FeCl3 có bao nhiêu gam nguyên tử clo?
A. 71,0 gam.
B. 35,5 gam.
C. 142,0 gam
D. 106,5 gam.
Câu 4: Có bao nhiêu mol nguyên tử O trong 1 mol phân tử N2O5?
A. 2 mol.
B. 4 mol.
C. 5 mol.
D. 3 mol.
Câu 5: Khối lượng của Fe trong 92,8 g Fe3O4 là
A. 25,6 g.
B. 67,2 g.
C. 80 g.
D. 10 g.
Đúng 1
Bình luận (0)
Câu 3: Thành phần phần trăm về khối lượng của các nguyên tố C, H, O trong C2H6O lần lượt là A. 52,2%; 13%; 34,8%. B. 52,2%; 34,8%; 13%. C. 13%; 34,8%; 52,2%. D. 34,8%; 13%; 52,2%
Xem thêm câu trả lời
Tính thành phần trăm về khối lượng các nguyên tố trong hợp chất có công thức hóa học : Al(OH) 3
(Cho biết nguyên tử khối của: Al = 27 ; O = 16 ; H = 1 )
\(\%_{Al}=\dfrac{27}{78}.100\%=34,6\%\)
\(\%_O=\dfrac{16.3}{78}.100\%=61,5\%\)
\(\%_H=100\%-34,6\%-61,5\%=3,9\%\)
Đúng 2
Bình luận (0)
Thành phần phần trăm về khối lượng của nguyên tố kim loại M trong hỗn hợp MCl2 và MSO4 là 21,1%. Thành phần phần trăm về khối lượng của nguyên tố clo trong hỗn hợp trên là
A. 33,02%
B. 15,62%
C. 18,53%
D. 28,74%
Giải thích: Đáp án B
Xét trong 1 mol hỗn hợp :
- Gọi x là số mol MCl2 thì số mol của MSO4 là 1 - x
- Số mol của M : x + 1 - x = 1 mol
=> Khối lượng hỗn hợp là : (M + 71)x + (M + 96)(1 - x) = M + 96 - 25x
Phần trăm khối lượng M trong hỗn hợp là :
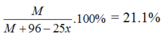
Ta có 0 < x < 1 => 18.9 < M < 25.7 => M = 24 (Mg)
=> x = 0.25 mol
=> khối lượng hỗn hợp là (24 + 71). 0,25 + (M + 96)(1 – 0,25) = 113.75g
=> %Cl = 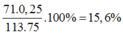
Đúng 0
Bình luận (0)
Thành phần phần trăm về khối lượng của nguyên tố kim loại M trong hỗn hợp MCl2 và MSO4 là 21,1%. Thành phần phần trăm về khối lượng của nguyên tố clo trong hỗn hợp trên là A. 33,02%. B. 15,60%. C. 18,53%. D. 28,74%.
Đọc tiếp
Thành phần phần trăm về khối lượng của nguyên tố kim loại M trong hỗn hợp MCl2 và MSO4 là 21,1%. Thành phần phần trăm về khối lượng của nguyên tố clo trong hỗn hợp trên là
A. 33,02%.
B. 15,60%.
C. 18,53%.
D. 28,74%.
Đốt cháy hoàn toàn 1,8 g một loại phân đạm A thu được 1,32 gam CO2 1,08 gam H2O Tính thành phần phần trăm khối lượng N trong A và 46,67% trong A ngoài C H Ncòn nguyên tố O a .cho biết phần trăm khối lượng các nguyên tố trong A b. lập công thức hóa học của A Biết rằng lượng Nitơ trong 1 mol A ít hơn lượng Nitơ trong 100 gam NH4NO3
Đốt cháy hoàn toàn 1,8 g một loại phân đạm A thu được 1,32 gam CO2 1,08 gam H2O Tính thành phần phần trăm khối lượng N trong A và 46,67% trong A ngoài C H Ncòn nguyên tố O a .cho biết phần trăm khối lượng các nguyên tố trong A b. lập công thức hóa học của A Biết rằng lượng Nitơ trong 1 mol A ít hơn lượng Nitơ trong 100 gam NH4NO3
nCO2 = 0,03 mol → nC = nCO2 = 0,03 mol
nH2O = 0,06 mol → nH = 2nH2O = 0,12 mol
mN = 1,8.46,67% = 0,84 gam → nN = 0,84/14 = 0,06 mol
→ mO = mA - mC - mH - mN = 1,8 - 0,03.12 - 0,12 - 0,06.14 = 0,48 gam
→ nO = 0,48/16 = 0,03 mol
→ C : H : O : N = 0,03 : 0,12 : 0,03 : 0,06 = 1 : 4 : 1 : 2
→ CTPT có dạng (CH4ON2)n
Mà N trong 1 mol A ít hơn N trong 100 gam NH4NO3 nên ta có:
2n < 2.(100/80) → n < 1,25
→ n = 1
→ CTPT là CH4ON2 hay (NH2)2CO
Tên gọi của A là ure
Đúng 0
Bình luận (3)
BÀI TẬP TỰ LUẬN CHỦ ĐỀ 6Bài 1: Hãy tính thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chấta) CaCO3b) Fe2O3Bài 2: Tìm CTHH của các hợp chất sau, biết thành phần phần trăm các nguyên tố là:a) 52,174%C; 13,043% H và 34,783%O. Biết khối lượng mol của hợp chất A là 46 g/molb) 28,7%Mg, 14,2%C, còn lại là oxygen. Biết khối lượng mol của hợp chất A là 84 g/molBài 3: Hòa tan hoàn toàn 14 gam kim loại Fe, trong dung dịch HCl dư. Phản ứng hóa học được biểu diễn theo sơ đồ...
Đọc tiếp
BÀI TẬP TỰ LUẬN CHỦ ĐỀ 6 Bài 1: Hãy tính thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất a) CaCO3 b) Fe2O3 Bài 2: Tìm CTHH của các hợp chất sau, biết thành phần phần trăm các nguyên tố là: a) 52,174%C; 13,043% H và 34,783%O. Biết khối lượng mol của hợp chất A là 46 g/mol b) 28,7%Mg, 14,2%C, còn lại là oxygen. Biết khối lượng mol của hợp chất A là 84 g/mol Bài 3: Hòa tan hoàn toàn 14 gam kim loại Fe, trong dung dịch HCl dư. Phản ứng hóa học được biểu diễn theo sơ đồ sau: Fe + HCl → FeCl2 + H2 a) Hãy lập phương trình hóa học của phản ứng. b) Tính thể tích (ở đkc) của khí H2 sinh ra. c) Tính khối lượng acid HCl đã tham gia phản ứng. Bài 4: Cho sơ đồ phản ứng: CaCO3 + HCl → CaCl2 + CO2 + H2O. a) Nếu có 9,916 lít khí CO2 (đkc) tạo thành thì cần dùng bao nhiêu gam CaCO3, bao nhiêu gam HCl tham gia phản ứng? b) Nếu có 20 gam CaCO3 tham gia phản ứng, hãy tính khối lượng HCl cần dùng và thể tích khí CO2 sinh ra ở đkc? Bài 5: Cho sơ đồ : Zn + HCl → ZnCl2 + H2. Nếu có 16,25 g Zn tham gia phản ứng, hãy tính: a) Tính khối lượng của HCl? b) Tính thể tích của H2 ở đkc c) Tính khối lượng của ZnCl2 (bằng hai cách). |








