hoà tan 24 4g bacl2.xh2o vào 175,6g nước thu dc dd 10,4%. tính kl bacl2 có trong dd và tìm x
TN
Những câu hỏi liên quan
Hoà tan 1,17 gam nacl vào 2,08 gam BaCl2 vào nước thu được 100ml dd X.Tính nồng độ mol các ion trong dung dịch X
\(n_{NaCl}=\dfrac{1,17}{58,5}=0,02\left(mol\right)\\ n_{BaCl_2}=\dfrac{2,08}{208}=0,01\left(mol\right)\\ \left[Na^+\right]=\dfrac{0,02}{0,1}=0,2\left(M\right)\\ \left[Ba^{2+}\right]=\dfrac{0,01}{0,1}=0,1\left(M\right)\\ \left[Cl^-\right]=\dfrac{0,02+0,01.2}{0,1}=0,4\left(M\right)\)
Đúng 2
Bình luận (0)
Cho150g dd bacl2 10,4% vao250g dd h2so4 9,8% thu được dung dịch x. Tính c% các chất tan có trong x
mbacl2=150.10,4/100=15,6g=>nbacl2=15,6/208=0,075mol
mh2so4=250.9,8/100=24,5g=>nh2so4=24,5/98=0,25mol
pt: bacl2 + h2so4 -> baso4 + 2 hcl
ncó: 0,075 0,25
npứ: 0,075 0,075 0,075 0,15
ndư: 0 0,175
dd x sau pứ hcl và h2so4 dư
=> mbaso4=0,075.233=17,475g
mdd x=mdd bacl2 +mdd h2so4-mbaso4=150+250-17,475=382,525g
=>mhcl=0,175.36,5=6,3875g=>C%=6,3875/382,525.100~1,670%
=>mh2so4 dư=0,175.98=17,15g=>C%=17,15/382,525.100~4,483%
Đúng 0
Bình luận (0)
Hoà tan 1,952 g muối
B
a
C
l
2
.
x
H
2
O
trong nước. Thêm
H
2
S
O
4
loãng, dư vào dung dịch thu được. Kết tủa tạo thành được làm khô và cân được 1,864 g. Xác định công thức hoá học của muối.
Đọc tiếp
Hoà tan 1,952 g muối B a C l 2 . x H 2 O trong nước. Thêm H 2 S O 4 loãng, dư vào dung dịch thu được. Kết tủa tạo thành được làm khô và cân được 1,864 g. Xác định công thức hoá học của muối.
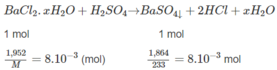
⇒ M = 244g/mol = M B a C l 2 . x H 2 O . Từ đó :
⇒ x = 2.
Đáp số : B a C l 2 . x H 2 O
Đúng 0
Bình luận (0)
1. hòa tan 8g NaCl vào trong 62g H2O tính C% NaCl
2 tính mMg và mH2O có 400g dd tính mCl2 19%
3 hòa tan 40g BaCl2 vào muối thu được BaCl 8%
tính mH2O cần dùng
1.Hoà tan 5.6g Fe trong dd HNO3 6.3% Vừa thu đc V lit khí NO (đktc). Tính kl HNO3 đã dùng và C% của dd muối thu đc
2.hòa tan hoàn toàn ag FeSO4. 7H2O trong Nước thu đc dd A. Dd A làm mất màu 200ml dd KMnO4 1M trong H2So4 dư. Tính a?
Bài 1:
Ta có: \(n_{Fe}=0,1\left(mol\right)\)
PT: \(Fe+4HNO_3\underrightarrow{t^o}Fe\left(NO_3\right)_3+NO+2H_2O\)
___0,1_____0,4_____0,1_______0,1 (mol)
\(\Rightarrow m_{HNO_3}=0,4.63=25,2\left(g\right)\)
\(\Rightarrow m_{ddHNO_3}=\dfrac{25,2}{6,3\%}=400\left(g\right)\)
Ta có: m dd sau pư = mFe + m dd HNO3 - mNO = 5,6 + 400 - 0,1.30 = 402,6 (g)
\(\Rightarrow C\%_{Fe\left(NO_3\right)_3}=\dfrac{0,1.242}{402,6}.100\%\approx6,01\%\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (0)
Bài 2 :
n KMnO4 = 0,2(mol)
$Mn^{+7} + 5e \to Mn^{+2}$
$Fe^{+2} \to Fe^{+3} + 1e$
Bảo toàn electron :
n FeSO4 = 5n KMnO4 = 0,2.5 = 1(mol)
n FeSO4.7H2O = n FeSO4 = 1(mol)
=> a = 1.278 = 278(gam)
Đúng 2
Bình luận (0)
Bài 1 :
n Fe = 5,6/56 = 0,1(mol)
Bảo toàn electron :
3n Fe = 3n NO
=> n NO = 0,1(mol)
n HNO3 = 4n NO = 0,4(mol)
=> m HNO3 = 0,4.63 = 25,2(gam)
=> m dd HNO3 = 25,2/6,3% = 400(gam)
Sau phản ứng :
n Fe(NO3)3 = n Fe = 0,1(mol)
m dd = 5,6 + 400 - 0,1.30 = 402,6(gam)
C% Fe(NO3)3 = 0,1.242/402,6 .100% = 6,01%
Đúng 0
Bình luận (1)
Xem thêm câu trả lời
Cho 200g dd Bacl2 10,4% td vừa đủ với 328,3(g) đ H2SO4 thu đc kết tủa a và dd b
a .PTHH?
b. Tính KL kết tủa a và KL dd b
c. Biết 1ml đ b có KL là 1,01g. Tính Cm của chất tan trong dd b
d.Thêm vào dd b 4,2g bột sắt . kết thúc phản ứng sắt có tan hết hay k ? Tính V khí sinh ra ( đktc )
Mong mn giúp em sớm em đang cần gấp lắm ạ
\(m_{BaCl_2}=\dfrac{200.10,4}{100}=20,8\left(g\right)\)
\(n_{BaCl_2}=\dfrac{20,8}{208}=0,1\left(mol\right)\)
\(a.BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
mol 0,1 → 0,1 0,1 0,2
b.\(m_{BaSO_4}=0,1.233=23,3\left(g\right)\)
\(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
Đúng 0
Bình luận (0)
a. PTHH :
BaCl2 + H2SO4 ---> BaSO4 + 2HCl (1)
=> Kết tủa a là BaSO4 , b là dd HCl
b. ADCT : \(m_{ct}\) = \(\dfrac{m_{dd}\cdot C\%}{100\%}\)=> \(m_{BaCl_2}\)= \(\dfrac{200\cdot10,4\%}{100\%}\)= 20,8 (g)
ADCT : n = \(\dfrac{m}{M}\)=> \(n_{BaCl_2}\)= \(\dfrac{20,8}{208}\)= 0,1 (mol)
Theo (1) : \(n_{BaCl_2}\)= \(n_{BaSo_4}\) = 0,1 (mol)
ADCT : m=n.M => \(m_{BaSO_4}\)= 0,1.233= 23,3 (g)
ADĐLBTKL ta có :
\(m_{ddBaCl_2}\) + \(m_{ddH_2SO_4}\) = \(m_{BaSO_4}\) + \(m_{ddHCl}\)
=> \(m_{ddHCl}=\) 200 + 328,3 - 23,3 = 505 (g)
c. Ta có : \(V_{ddHCl}=\)505 : 1,01=500(ml)=0,5(l)
Theo (1) : \(n_{HCl}=2n_{BaCl_2}\)= 0,2 (mol)
ADCT : \(C_M\) = \(\dfrac{n}{V}\)=> \(C_{M_b}=\dfrac{0,2}{0,5}\)= 0,4M
d. ADCT : n = \(\dfrac{m}{M}\)=> \(n_{Fe}=\dfrac{4,2}{56}=0,075\left(mol\right)\)
PTHH:
Fe + 2HCl --> \(FeCl_2\) + \(H_2\)
mol trước pứ : 0,075 0,2 (mol)
mol trong pứ: 0,075->0,15--------------->0,075 (mol)
mol sau pứ : 0 -->0,05---------------->0,075 (mol)
=> Fe hết, HCl dư
ADCT : V=n.22,4=> \(V_{H_2}\)= 0,075.22,4=1,68 (l)
Đúng 0
Bình luận (0)
Trộn 200g dd CuSO4 32°/• với 200g dd BaCl2 10,4 °/• a) viết ptpư b) tính khối lượng chất rắn sinh ra c) tính C °/• các chất có trong dd sau phản ứng
\(m_{CuSO_4}=\dfrac{200\cdot32}{100}=64\left(g\right)\)\(\Rightarrow n_{CuSO_4}=\dfrac{64}{160}=0,4mol\)
\(m_{BaCl_2}=\dfrac{200\cdot10,4}{100}=20,8\left(g\right)\)\(\Rightarrow n_{BaCl_2}=\dfrac{20,8}{208}=0,1mol\)
\(CuSO_4+BaCl_2\rightarrow BaSO_4\downarrow+CuCl_2\)
0,4 0,1 0,1 0,1
b)\(m_{BaSO_4}=0,1\cdot233=23,3\left(g\right)\)
c)\(m_{CuCl_2}=0,1\cdot135=13,5\left(g\right)\)
\(\Rightarrow m_{ddsau}=200+200-13,5=386,5\left(g\right)\)
\(\Rightarrow C\%=\dfrac{23,3}{386,5}\cdot100\%=6,028\%\)
Đúng 0
Bình luận (2)
hòa tan 21,5g hỗn hợp BaCl2 và CaCl2 vào 178,5ml nước để được dung dịch A. Thêm vào dung dịch A 175ml dd Na2CO3 1M thấy tách ra 19,85g kết tủa và nhận được 400ml dd B. Tính C% dd BaCl2 và CaCl2 ( gợi ý cho mọi người là bài tăng giảm khối lượng và mn hãy giải thích rõ khúc tăng giảm ấy giúp mk vs ạ!!!!!!!!!)
Trộn 300g dd H2SO4 9,8% với 200g dd BaCl2 26%, thu được a gam kết tủa và dd X a) Viết PTHH. Tính ab) Xác định nồng độ % các chất trong dd Xc) Toàn bộ dd X được trung hoà bằng V lít dd NaOH 1M. Tính V Bài 4: Ngâm 1 lá kẽm trong 32g dd CuSO4 10% cho tới khi kẽm không thể tan được nữa. a) Viết PTHH. Phản ứng trên thuộc loại phản ứng gì?b) Tính khối lượng kẽm đã phản ứng.c) Xác định nồng độ % của dd sau phản ứng.
Đọc tiếp
Trộn 300g dd H2SO4 9,8% với 200g dd BaCl2 26%, thu được a gam kết tủa và dd X a) Viết PTHH. Tính a
b) Xác định nồng độ % các chất trong dd X
c) Toàn bộ dd X được trung hoà bằng V lít dd NaOH 1M. Tính V
Bài 4: Ngâm 1 lá kẽm trong 32g dd CuSO4 10% cho tới khi kẽm không thể tan được nữa. a) Viết PTHH. Phản ứng trên thuộc loại phản ứng gì?
b) Tính khối lượng kẽm đã phản ứng.
c) Xác định nồng độ % của dd sau phản ứng.




