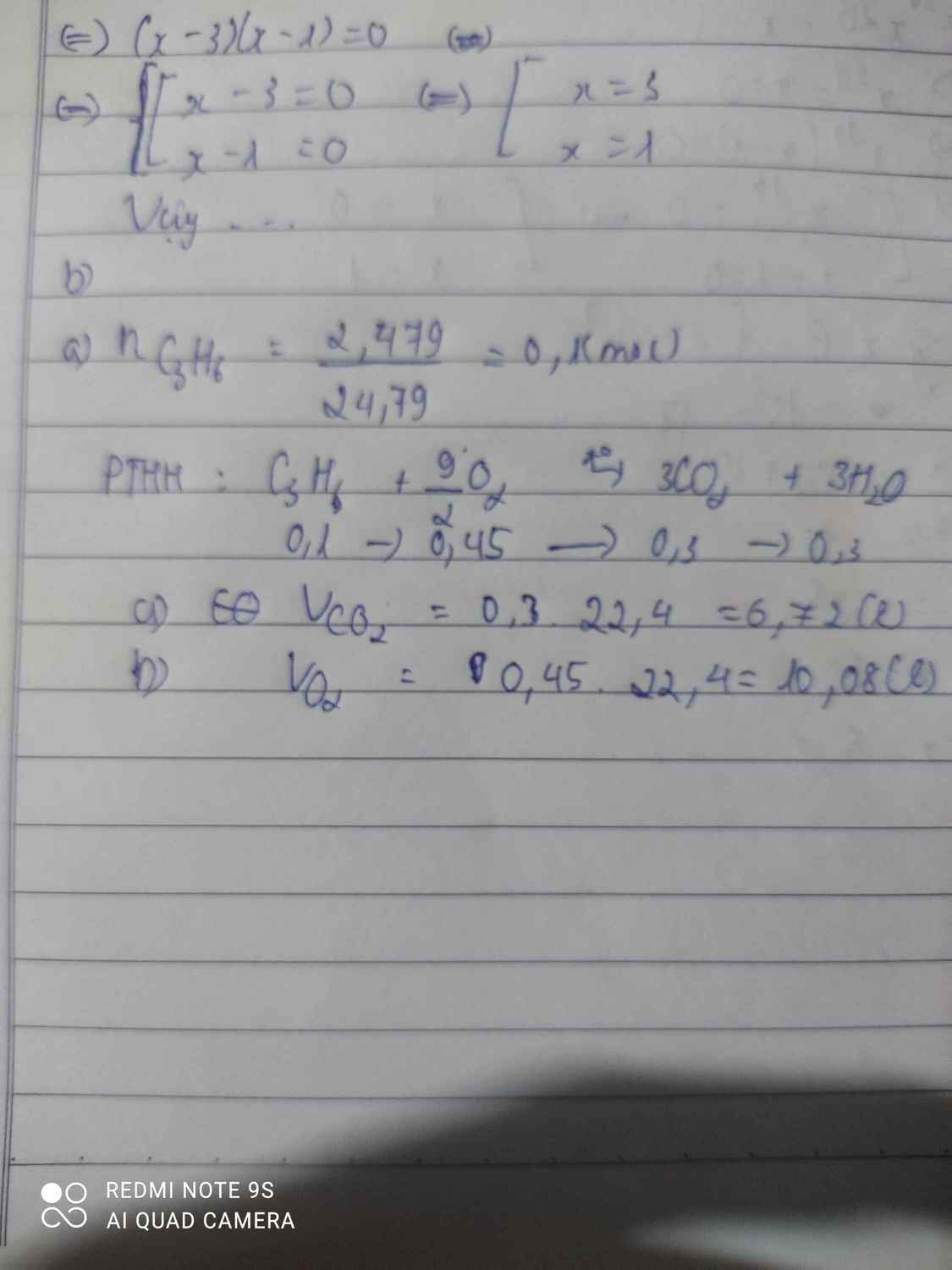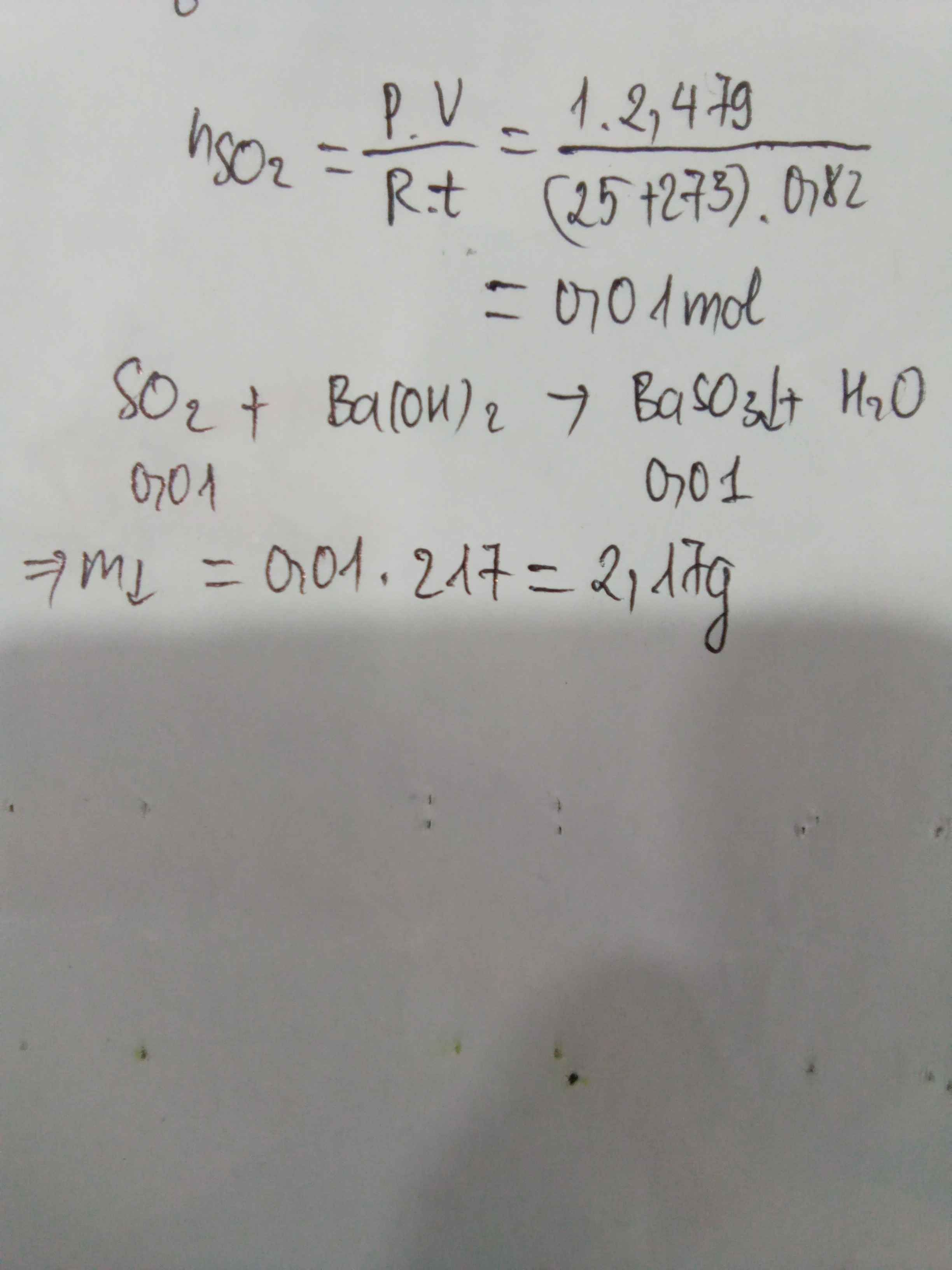6,2g phosphorus đỏ+ 2,479 lít oxygen(đkc) a) m sản phẩm. b) m chất dư
H24
Những câu hỏi liên quan
Đốt cháy hoàn toàn Phosphorus trong bình chứa 2,479 lit Oxygen (đkc) thu được hơp chất có công thức P2O5. Tính khối lượng sản phẩm thu được.
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
\(nO_2=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
\(\Rightarrow nP_2O_5=\dfrac{2}{5}.nO_2=\dfrac{2}{5}.0,1=0,04\left(mol\right)\)
\(mP_2O_5=0,04.142=5,68\left(g\right)\)
Đúng 2
Bình luận (1)
nO2 = 2,479/24,79 = 0,1 (mol)
PTHH: 4P + 5O2 -> (t°) 2P2O5
Mol: 0,08 <--- 0,1 ---> 0,04
mP2O5 = 0,05 . 142 = 5,68 (g)
Đúng 2
Bình luận (3)
nO2 = 2,479/24,79 = 0,1 (mol)
PTHH: 4P + 5O2 -> (t°) 2P2O5
Mol: 0,08 <--- 0,1 ---> 0,04
mP2O5 = 0,05 . 142 = 5,68 (g)
Đúng 0
Bình luận (0)
Đốt chảy hoàn toàn m (g) phosphorus đò trong bình chữa 6,21 lít khí oxygen (ở 25 độ, 1 bar) tạo thành chất rắn màu trắng ( P2O5 diphosphorus pentoxide). a ) Viết PTHH b )Tính khối lượng chất rắn tạo thành . c ) Tính m (g) phosphorus đỏ .
\(n_{O_2}=\dfrac{V_{O_2}}{24,79}=\dfrac{6,21}{24,79}=0,25mol\)
\(4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\)
0,2 0,25 0,1 ( mol )
\(m_{P_2O_5}=n_{P_2O_5}.M_{P_2O_5}=0,1.142=14,2g\)
\(m_P=n_P.M_P=0,2.31=6,2g\)
Đúng 1
Bình luận (1)
Câu 1: Cho 16,8 gam sắt (iron) cháy trong bình chứa 2,479 lít khí oxygen ở (đkc) thu được Iron oxide (Fe3O4)a. Chất nào còn dư sau phản ứng, tính khối lượng chất dư.b. Tính khối lượng của Iron oxide (Fe3O4).Câu 2: Hoà tan hết 12 gam một kim loại R (hoá trị II) bằng dung dịch H2SO4 loãng thu được 7,437 lít khí H2 (đkc). Tìm R
Đọc tiếp
Câu 1: Cho 16,8 gam sắt (iron) cháy trong bình chứa 2,479 lít khí oxygen ở (đkc) thu được Iron oxide (Fe3O4)
a. Chất nào còn dư sau phản ứng, tính khối lượng chất dư.
b. Tính khối lượng của Iron oxide (Fe3O4).
Câu 2: Hoà tan hết 12 gam một kim loại R (hoá trị II) bằng dung dịch H2SO4 loãng thu được 7,437 lít khí H2 (đkc). Tìm R
Câu 1
\(n_{Fe}=\dfrac{16,8}{56}=0,3mol\\ n_{O_2}=\dfrac{2,479}{24,79}=0,1mol\\ 3Fe+2O_2\xrightarrow[t^0]{}Fe_3O_4\\ \Rightarrow\dfrac{0,3}{3}>\dfrac{0,1}{2}\Rightarrow Fe.dư\\ 3Fe+2O_2\xrightarrow[t^0]{}Fe_3O_4\)
0,15 0,1 0,05
\(m_{Fe.dư}=16,8-0,15.56=8,4g\\ b.m_{Fe_3O_4}=0,05.232=11,6g\)
Đúng 2
Bình luận (0)
Câu 2
\(n_{H_2}=\dfrac{7,437}{24,79}=0,3mol\\ R+H_2SO_4\rightarrow RSO_4+H_2\\ n_{H_2}=n_R=0,3mol\\ M_R=\dfrac{12}{0,3}=40g/mol\)
Vậy M là Canxi
Đúng 2
Bình luận (0)
hoà tan m gam hỗn hợp Cu và Zn vào dd H2SO4 loãng dư thu được dd X, một kim loại khong tan, và 2,479 lít khí (đkc). Lấy toàn bộ lượng kim loại không tan thu được cho hoà tan vào x gam dd H2SO4 đặc nóng 98% thấy thu được 2,9748 lít khí SO2 (đkc) (sản phẩm khử duy nhất) a)PTHH b)tính m,x
a, \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O\)
b, Ta có: \(n_{H_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
\(n_{Zn}=n_{H_2}=0,1\left(mol\right)\)
\(n_{SO_2}=\dfrac{2,9748}{24,79}=0,12\left(mol\right)\)
\(n_{Cu}=n_{SO_2}=0,12\left(mol\right)\)
\(\Rightarrow m=m_{Zn}+m_{Cu}=0,1.65+0,12.64=14,18\left(g\right)\)
Có: \(n_{H_2SO_{4\left(đ\right)}}=2n_{SO_2}=0,24\left(mol\right)\Rightarrow x=m_{ddH_2SO_4\left(đ\right)}=\dfrac{0,24.98}{98\%}=24\left(g\right)\)
Đúng 3
Bình luận (0)
đốt cháy 2,479 lít propane trong khí oxygen (đkc) thì thu được khí carbonic và hơi nước
a. Tính thể tích khí CO2 thu được.
b. Tính thể tích khí oxygen cần dùng.
n C3H8=0,1 mol
C3H8+5O2-to>3CO2+4H2O
0,1-----0,5------------0,3-----0,4 mol
=>VCO2=0,3.22,4=6,72 l
=>VO2=0,5.22,4=11,2l
Đúng 3
Bình luận (0)
Đốt cháy 26 gam Zn trong bình chứa 7,437 lít khí O2 (đkc).
a) Chất nào còn dư, dư bao nhiêu gam?
b) Tính khối lượng sản phẩm thu được.
a) nZn = 26/65 = 0,4 (mol)
PTHH: 2Zn + O2 -> (t°) 2ZnO
LTL: 0,4/2 < 0,3 => O2 dư
nO2 (p/ư) = 0,4/2 = 0,2 (mol)
mO2 (dư) = (0,3 - 0,2) . 32 = 3,2 (g(
b) nZnO = 0,4 (mol)
mZnO = 0,4 . 81 = 32,4 (g)
Đúng 3
Bình luận (1)
a. \(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{7.437}{24,79}=0,3\left(mol\right)\)
Ta thấy : 0,4 > 0,3 => Zn dư , O2 đủ
PTHH : 2Zn + O2 ----to---> 2ZnO
0,6 0,3 0,6
\(m_{Zn\left(dư\right)}=\left(0,4-0,6\right).65=-13\left(g\right)\)
b. \(m_{ZnO}=0,6.81=48,6\left(g\right)\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn kim loại đồng trong 2,479 lít khí oxygen (đkc) hỏi có bao nhiêu gam copper (II) oxide (CuO) tạo thành ? cho: Cu=64 , O=16
\(n_{O_2}=\dfrac{2,479}{24,79}=0,1(mol)\\ 2Cu+O_2\xrightarrow{t^o}2CuO\\ \Rightarrow n_{CuO}=0,2(mol)\\ \Rightarrow m_{CuO}=0,2.80=16(g)\)
Đúng 0
Bình luận (0)
Nung 12,25g Potassium chloride KClO3
a. Tính thể tích khí Oxygen sinh ra (đkc)
b. Tính khối lượng KCl tạo thành sau phản ứng
c. Dùng khí Oxygen vừa tạo thành. Đốt 3,1g phosphorus thì phosphorus có cháy hết không?
\(n_{KClO_3}=\dfrac{12,25}{122,5}=0,1\left(mol\right)\)
PTHH: 2KClO3 -to, MnO2-> 2KCl + 3O2
0,1--------------------->0,1--->0,15
=> \(\left\{{}\begin{matrix}V_{O_2}=0,15.24,79=3,7185\left(l\right)\\m_{KCl}=0,1.74,5=7,45\left(g\right)\end{matrix}\right.\)
\(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
LTL: \(\dfrac{0,1}{4}< \dfrac{0,15}{5}\) => P có cháy hết
Đúng 2
Bình luận (0)
cho 2,479 lít SO2 ( đkc : 25 độ C , 1 Bar ) tác dụng với dd Ba(OH)2 dư . Hãy tính khối lượng chất kết tủa thu được ?