
Kiểm tra chương IV Oxi-Không khí: Đề 2
a, PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Theo PT: \(n_{Al_2O_3}=\dfrac{1}{2}n_{Al}=0,1\left(mol\right)\Rightarrow m_{Al_2O_3}=0,1.102=10,2\left(g\right)\)
c, Theo PT: \(n_{O_2}=\dfrac{3}{4}n_{Al}=0,15\left(mol\right)\Rightarrow V_{O_2}=0,15.22,4=3,36\left(l\right)\)
\(\Rightarrow V_{kk}=\dfrac{V_{O_2}}{20\%}=16,8\left(l\right)\)
d, PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Theo PT: \(n_{KClO_3}=\dfrac{2}{3}n_{O_2}=0,1\left(mol\right)\Rightarrow m_{KClO_3}=0,1.122,5=12,25\left(g\right)\)
Đúng 1
Bình luận (0)
a) \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
0,2-->0,15--->0,1
b) \(m_{Al_2O_3}=0,1.102=10,2\left(g\right)\)
c) \(V_{kk}=\dfrac{0,15.22,4}{20\%}=16,8\left(l\right)\)
d) \(2KClO_3\xrightarrow[]{t^o}2KCl+3O_2\)
0,1<-----------------0,15
\(\Rightarrow m_{KClO_3}=0,1.122,5=12,25\left(g\right)\)
Đúng 0
Bình luận (0)
đốt cháy 5,4 gam al trong bình chứa oxi
a,viết pthh
b, tính thể tích oxi cần dùng đo ở đktc
c, tính khối lượng KMnO4 cần dùng để điều chế lượng oxi trên
a) \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
0,2--->0,15
b) \(V_{O_2}=0,15.22,4=3,36\left(l\right)\)
c) PTHH: \(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\)
0,3<-----------------------------------0,15
\(\Rightarrow m_{KMnO_4}=0,3.158=47,4\left(g\right)\)
Đúng 1
Bình luận (0)
cho 3,9 g kali tách dùng hoàn toàn vs nc.
a)tính thể tích h2 sinh ra ở đk tc
b) tính khối lượng nước đã dùng
`2K + 2H_2 O -> 2KOH + H_2↑`
`0,1` `0,1` `0,05` `(mol)`
`n_K = [ 3,9 ] / 39 = 0,1 (mol)`
`a) V_[H_2] = 0,05 . 22,4 = 1,12 (l)`
`b)m_[H_2 O] = 0,1 . 18 = 1,8 (g)`
Đúng 4
Bình luận (0)
Giúp em với đang gấp ạ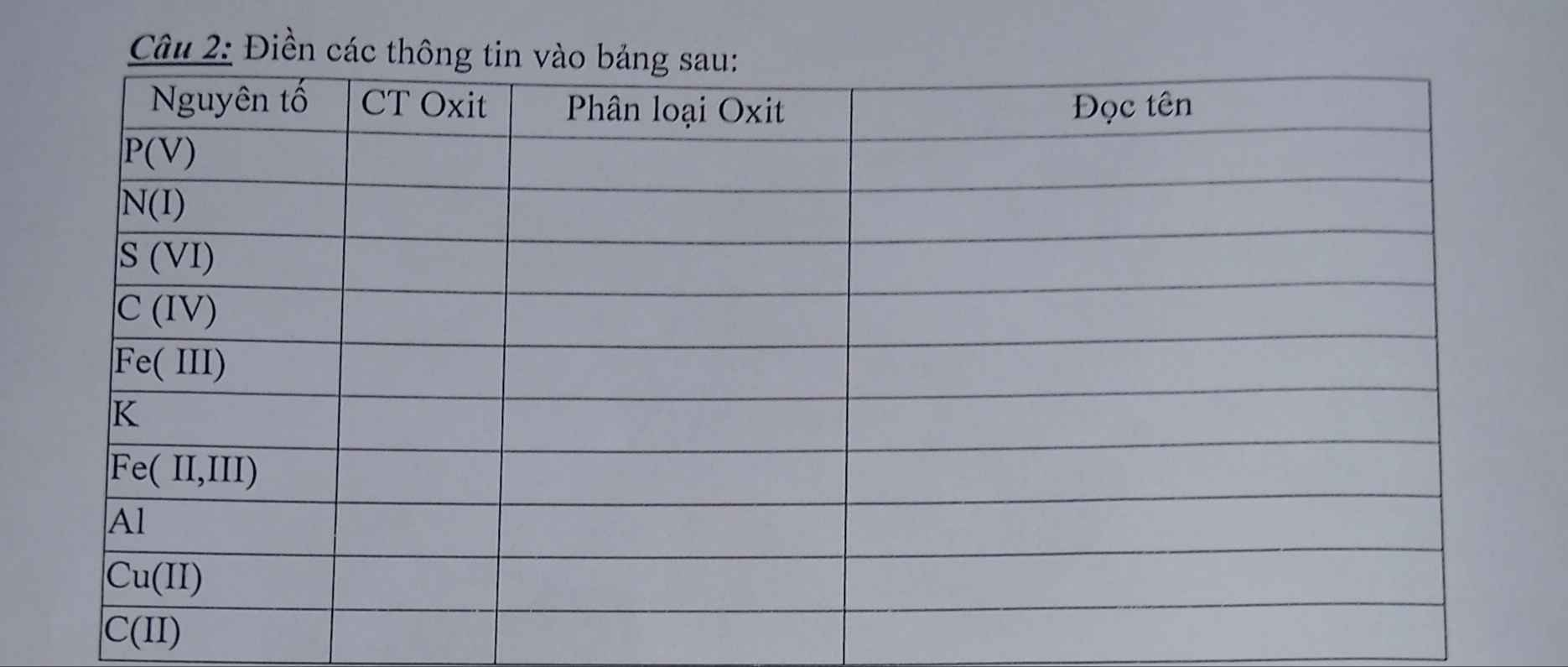
| Nguyên tố | CT oxit | Phân loại | Đọc tên |
| P(V) | P2O5 | oxit axit | Điphotpho pentaoxit |
| N(I) | N2O | oxit trung tính | Đinitơ oxit |
| S(VI) | SO3 | oxit axit | Lưu huỳnh trioxit |
| C(IV) | CO2 | oxit axit | Cacbon đioxit |
| Fe(III) | Fe2O3 | oxit bazo | Sắt (III) oxit |
| K | K2O | oxit bazo | Kali oxit |
| Fe(II,III) | Fe3O4 | oxit bazo | Sắt từ oxit |
| Al | Al2O3 | oxit lưỡng tính | Nhôm oxit |
| Cu(II) | CuO | oxit bazo | Đồng (II) oxit |
| C(II) | CO | oxit trung tính | Cacbon oxit |
Đúng 0
Bình luận (0)
Giúp với ạ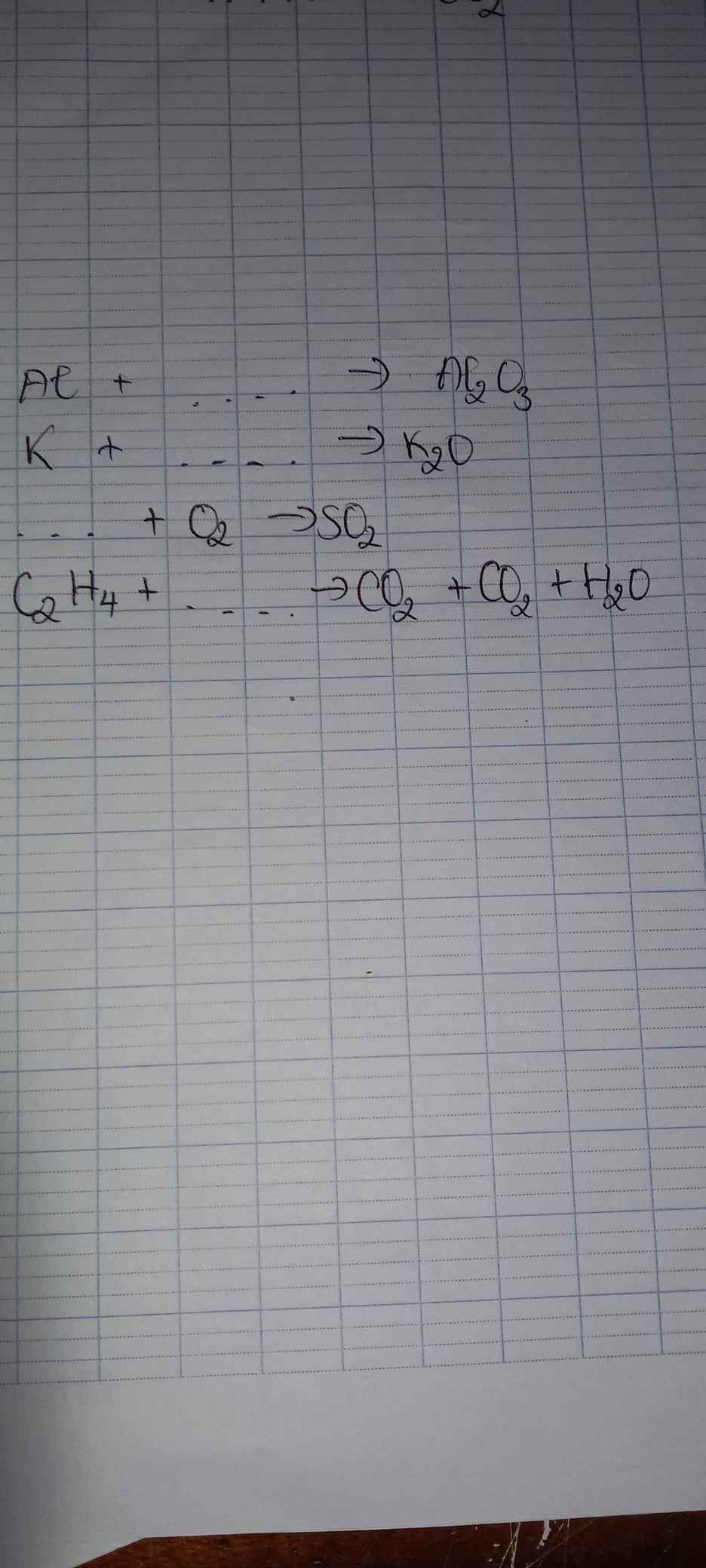
4Al+3O2-to>2Al2O3
4K+O2-to>2K2O
S+O2-to>SO2
C2H4+3O2-to>2CO2+2H2O
Đúng 2
Bình luận (0)
4Al + 3O2 -> (t°) 2Al2O3
4K + O2 -> 2K2O
S + O2 -> (t°) SO2
C2H4 + 3O2 -> (t°) 2CO2 + 2H2O
Đúng 1
Bình luận (1)
4Al + 3O2 ⇒ 2Al2O3
4K + O2 ⇒ 2K2O
S + O2 ⇒ SO2
C2H4 + 3O2 ⇒ 2CO2 + 2H2O (hình như đề câu này bạn viết sai)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Giúp mìn với ạ
6,2g phosphorus đỏ+ 2,479 lít oxygen(đkc) a) m sản phẩm. b) m chất dư
\(n_P=\dfrac{6,2}{31}=0,2mol\)
\(n_{O_2}=\dfrac{2,479}{22,4}\approx0,11mol\)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
Bđ 0,2 0,11
Pư 0,088 0,11 0,044
Kt 0,112 0 0,044
a)\(m=m_{P_2O_5}=0,044\cdot142=6,248g\)
b)\(m_{dư}=m_P=0,112\cdot31=3,472g\)
Đúng 1
Bình luận (1)
Hòa tan hoàn toàn 17,1 gam hỗn hợp A gồm Mg và Al tác dụng vừa đủ với dung dịch axit clohidric (HCl). Sau phản ứng thu được dung dịch B và 18,48 lít khí hidro thoát ra (đo ở điều kiện tiêu chuẩn). a. Tính các phương trình hóa học xảy ra. b. Tính thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp A
\(a.Mg+2HCl\rightarrow MgCl_2+H_2\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ b.Đặt:\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\\ n_{H_2}=\dfrac{18,48}{22,4}=0,825\left(mol\right)\\ Tacó:\left\{{}\begin{matrix}24x+27y=17,1\\x+\dfrac{3}{2}y=0.825\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,375\\y=0,3\end{matrix}\right.\\ \Rightarrow\%m_{Mg}=\dfrac{0,375.24}{17,1}.100=52,63\%\\ \%m_{Al}=47,37\%\)
Đúng 1
Bình luận (0)
Dùng 44,8 lit không khí phản ứng với 1,344 lit khí propan (C3H8). Tính: a/ Thể tích chất dư. Biết thể tích các khí đo ở đkc và thể tích khí Oxi chiếm 1/5 thể tích không khí b/ Khối lượng CO2 và H2O thu được
V(O2)= 20%.Vkk=20%. 44,8= 8,92(l) => nO2=0,4(mol)
nC3H8= 1,344/22,4= 0,06(mol)
PTHH: C3H8 + 5 O2 -to-> 3 CO2 + 4 H2O
Ta có: 0,06/1 < 0,4/5
=> O2 dư, C3H8 hết, tính theo nC3H8
=> nO2(p.ứ)= 0,06.5=0,3(mol)=> nO2(dư)=0,4-0,3=0,1(mol)
=> V(O2,dư)=0,1.22,4=2,24(l)
b) nCO2=3.0,06=0,18(mol)
=>mCO2=0,18 . 44=7,92(g)
nH2O=0,06.4=0,24(mol)
=>mH2O=0,24.18=4,32g)
Chúc em học tốt!
Đúng 1
Bình luận (0)
Mọi người chỉ mình cách giải bài này với ạ mình cảm ơn
â) 4P +5 O2 -to-> 2 P2O5
b) nO2=5,6/22,4=0,25(mol)
=>nP=0,25 x 4/5 =0,2(mol)
=>mP=0,2.31=6,2(g)
c) nP=15,5/31=0,5(mol)
Ta có: 0,5/4 > 0,25/5
-> P dư, O2 hết, tính theo nO2.
=> nP2O5=2/5. 0,25=0,1(mol
=>mP2O5=142.0,1=14,2(g)
Đúng 1
Bình luận (0)
\(n_{O_2}=0,25\left(mol\right)\)
\(\text{4P+5O_2\underrightarrow{t^o}2P_2O_5}\)
0,2 ←0,25
\(m_P=0,2.31=6,2\left(g\right)\)
Đúng 0
Bình luận (0)







