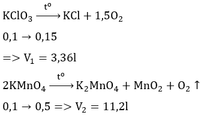Từ 0,1 mol H2SO4 có thể điều chế được SO2 với các thể tích ở (đktc) bằng 1,12 lít; 2,24 lít; 3,36 lít; 4,48 lít, viết các phương trình phản ứng để chứng minh điều đó
KR
Những câu hỏi liên quan
Trong phòng thí nghiệm có thể dùng những muối KClO3 hoặc KNO3 để điều chế khí oxi bằng phản ứng phân hủy.a) Viết các phương trình hóa học đối xới mỗi chất.b) Nếu dùng 0,1 mol mỗi chất thì thể tích khí oxi thu được có khác nhau hay không? Hãy tính thể tích khí oxi thu được.c) Cần điều chế 1,12 lít khí oxi, hãy tính khối lượng mỗi chất cần dùng.Các thể tích khí được đo ở điều kiện tiêu chuẩn.
Đọc tiếp
Trong phòng thí nghiệm có thể dùng những muối KClO3 hoặc KNO3 để điều chế khí oxi bằng phản ứng phân hủy.
a) Viết các phương trình hóa học đối xới mỗi chất.
b) Nếu dùng 0,1 mol mỗi chất thì thể tích khí oxi thu được có khác nhau hay không? Hãy tính thể tích khí oxi thu được.
c) Cần điều chế 1,12 lít khí oxi, hãy tính khối lượng mỗi chất cần dùng.
Các thể tích khí được đo ở điều kiện tiêu chuẩn.
a) Các phương trình phản ứng
2KNO3 2KNO2 + O2↑ (1)
2KClO3 2KCl + 3O2↑ (2)
b) Theo (1) và (2), thấy số mol hai muối tham gia phản ứng như nhau nhưng số mol oxi tạo thành khác nhau và do đó thể tích khí oxi thu được là khác nhau.
Theo (1): nO2 = nKNO3 =
= 0,05 mol; VO2 = 0,05x22,4 = 1,12 lít
Theo (2): nO2 = nKClO3 =
= 0,15 mol; VO2 = 0,15x22,4 = 3,36 lít
c) Để thu được 1,12 lít khí (0,05 mol) O2, thì:
Theo (1): nKNO3 = 2nO2 = = 0,1 mol; mKNO3 = 0,1x101 = 10,1 g
Theo (2): nKClO3 = nO2 =
x0,05 mol; VKClO3 =
x0,05x122,5 = 4,086 g.
Đúng 0
Bình luận (3)
a)
2KNO3 2KNO2 + O2↑ (1)
2KClO3 2KCl + 3O2↑ (2)
b)
Từ pt(1)=> nO2 = \(\frac{1}{2}\)nKNO3 = \(\frac{0,1}{2}\) = 0,05 mol
VO2 = 0,05.22,4 = 1,12 lít
Từ pt (2) => nO2 = \(\frac{3}{2}\)nKClO3 = \(\frac{0,1.3}{2}\) = 0,15 mol
V O2 = 0,15.22,4 = 3,36 lít
c)
Từ pt (1): nKNO3 = 2nO2 = = 0,1 mol
=>mKNO3 = 0,1.101 = 10,1 g
Từ pt (2): nKClO3 = \(\frac{2}{3}\)nO2 = \(\frac{2}{3}\).0,05 mol
V KClO3 = \(\frac{2}{3}\).0,05.122,5 = 4,086 g.
Đúng 0
Bình luận (0)
Thể tích khí SO2 thu được ở đktc khi đốt cháy hoàn toàn 3,2 gam lưu huỳnh là bao nhiêu?A. 1,12 lít B. 2,24 lít C. 3,36 lít D. 4,48 lítCâu 30. Khối lượng KClO3 cần dùng để điều chế được 3,36 lít khí oxi ở đktc là bao nhiêu?A. 6,125 gam B. 12,25 gam C. 18,375 gam D. 24,5 gamCâu 31. Khối lượng KMnO4 cần dùng để điều chế được 2,24 lít khí oxi ở đktc là bao nhiêu?A. 15,8 gam B. 23,7 gam C. 31,6 gam D. 47,4 gam.Câu 32. Thể tích khí H2 cần dùng ở đktc để khử hoàn toàn 8 gam đồng oxit (CuO) là bao nhiêu...
Đọc tiếp
Thể tích khí SO2 thu được ở đktc khi đốt cháy hoàn toàn 3,2 gam lưu huỳnh là bao nhiêu?
A. 1,12 lít B. 2,24 lít C. 3,36 lít D. 4,48 lít
Câu 30. Khối lượng KClO3 cần dùng để điều chế được 3,36 lít khí oxi ở đktc là bao nhiêu?
A. 6,125 gam B. 12,25 gam C. 18,375 gam D. 24,5 gam
Câu 31. Khối lượng KMnO4 cần dùng để điều chế được 2,24 lít khí oxi ở đktc là bao nhiêu?
A. 15,8 gam B. 23,7 gam C. 31,6 gam D. 47,4 gam.
Câu 32. Thể tích khí H2 cần dùng ở đktc để khử hoàn toàn 8 gam đồng oxit (CuO) là bao nhiêu?
A. 1,12 lít B. 2,24 lít C. 3,36 lít D. 4,48 lít
Câu 33. Khối lượng kim loại thu được khi cho 23,2 gam Ag2O phản ứng hoàn toàn với H2 dư, nung nóng là bao nhiêu?
A. 10,8 gam B. 16, 2 gam C. 21,6 gam D. 43,2 gam
Câu 34. Khối lượng chất rắn thu được khi đốt cháy 15,5 gam photpho trong bình chứa 11,2 lít khí oxi (ở đktc) là bao nhiêu?
A. 28,4 gam B. 35,5 gam C. 31,5 gam D. 56,8 gam
Câu 35. Khử hoàn toàn 46,4 gam hỗn hợp oxit CuO, FeO, Ag2O bằng V lít khí H2 vừa đủ, sau phản ứng thu được 40 gam kim loại. Giá trị của V là bao nhiêu?
A. 2,24 lít B. 4,48 lít C. 8,96 lít D. 13,44 lít
1 tính thể tích khí của các hỗn hợp chất khí sau ở đktc và tính điều kiện thường:
a )0,1 mol CO2 ; 0,2 mol NO2 ; 0,02 mol SO2 và 0,03 mol N2
b) 0,04 mol N2O; 0,015 mol NH3; 0,06 mol H2 ;0,08 mol H2S
2 tính thể tích khí ở đktc của
a )0,5 mol phân tử khí H2 ;0,8 mol phân tử khí O2
B )2 mol CO2 ; 3 mol khí CH4
C) 0,9 m khí N2; 1,5 mol khí H2
1.
\(a.\)
\(V_{hh}=\left(0.1+0.2+0.02+0.03\right)\cdot24=8.4\left(l\right)\)
\(b.\)
\(V_{hh}=\left(0.04+0.015+0.06+0.08\right)\cdot24=4.68\left(l\right)\)
\(2.\)
\(a.\)
\(V_{H_2}=0.5\cdot22.4=11.2\left(l\right)\)
\(V_{O_2}=0.8\cdot22.4=17.92\left(l\right)\)
\(b.\)
\(V_{CO_2}=2\cdot22.4=44.8\left(l\right)\)
\(V_{CH_4}=3\cdot22.4=67.2\left(l\right)\)
\(c.\)
\(V_{N_2}=0.9\cdot22.4=20.16\left(l\right)\)
\(V_{H_2}=1.5\cdot22.4=33.6\left(l\right)\)
Đúng 4
Bình luận (0)
Câu 1: Cho từ từ 0,25 mol khí HCl vào dung dịch A chứa 0,2 mol Na2CO3 và 0,1 mol NaHCO3. Thể tích CO2 thoát ra ( đktc ) là : A. 3,92 lít B. 1,12 lít C. 5,6 lít D. 3,36 lít
Tính khối lượng của
a/ 0.25 mol khí Co2
b/ 3.011 x 1023 phân tử khí CH4
Đúng 0
Bình luận (1)
đun nóng 0,1 mol etyl bromua trong dung dịch chứa KOH và etanol. Cho đến khi phản ứng xảy ra hoàn toàn, thể tích khí etilen thu được ở đktc là
A. 1,12 lít. B. 2,24 lít. C. 3,36 lít. D. 4,48 lít.
giải giúp mình nha
\(C_2H_5Br+KOH\underrightarrow{^{t^0,C_2H_5OH}}KBr+C_2H_4+H_2O\)
\(0.1....................................................0.1\)
\(V_{C_2H_4}=0.1\cdot22.4=2.24\left(l\right)\)
Đúng 2
Bình luận (0)
Nhiệt phân hoàn toàn 31,6 gam KMnO4 để điều chế oxi. Thể tích khí O2 thu được ở đktc là:(K 39; Mn 55; O 16) A.8,96 lít B.4,48 lít C.1,12 lít D.2,24 lít
Đọc tiếp
Nhiệt phân hoàn toàn 31,6 gam KMnO4 để điều chế oxi. Thể tích khí O2 thu được ở đktc là:
(K = 39; Mn = 55; O = 16)
A.8,96 lít
B.4,48 lít
C.1,12 lít
D.2,24 lít
Nhiệt phân hoàn toàn 31,6 gam KMnO4 để điều chế oxi. Thể tích khí O2 thu được ở đktc là:
(K = 39; Mn = 55; O = 16)
A.
8,96 lít
B.
4,48 lít
C.
1,12 lít
D.
2,24 lít
Đúng 1
Bình luận (0)
Tham khảo:
= 31,6/158 = 0,2 (mol)
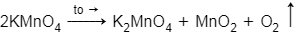
⇒ V = 0,1.22,4 = 2,24 (lít)
Đúng 1
Bình luận (1)
Xem thêm câu trả lời
Cho 1,12 gam sắt vào 50 ml dd H2SO4 1M.Sau phản ứng thu được dung dịch A và khí H2 (đktc). a) Tính V lít khí H2?
b) Tính thể tích dung dịch H2SO4 phản ứng.
c) Tính nồng độ mol của các chất trong dung dịch A.( Thể tích dung dịch không thay đổi đáng kể)
\(n_{Fe}=\dfrac{1,12}{56}=0,02\left(mol\right)\)
\(n_{H2SO4}=0,05.1=0,05\left(mol\right)\)
Pt : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
a) Xét tỉ lệ : \(0,02< 0,05\Rightarrow H2SO4dư\)
Theo Pt : \(n_{FeSO4}=n_{H2}=n_{Fe}=0,02\left(mol\right)\)
\(\Rightarrow V_{H2\left(dktc\right)}=0,02.22,4=0,448\left(l\right)\)
b) \(n_{H2SO4\left(dư\right)}=0,05-0,02=0,03\left(mol\right)\)
\(V_{ddH2SO4\left(dư\right)}=\dfrac{0,03}{1}=0,03\left(l\right)=30\left(ml\right)\)
c) \(C_{MFeSO4}=\dfrac{0,02}{0,05}=0,4\left(M\right)\)
\(C_{MH2SO4\left(dư\right)}=\dfrac{\left(0,05-0,02\right)}{0,05}=0,6\left(M\right)\)
Chúc bạn học tốt
Đúng 0
Bình luận (1)
Trong phòng thí nghiệm có thể dùng muối KClO3 hoặc KMnO4 để điều chế oxi bằng phản ứng phân hủy. Viết phương trình hóa học của các phản ứng và tính thể tích khí oxi thu được (đktc) khi nhiệt phân hoàn toàn 0,1 mol mỗi chất trên.
Hãy tìm :
(1) Số mol của 7,3g HCl ; 8,9 lít CH4 (đktc)
(2) Khối lượng của 0,2 mol H2SO4 ; 13,44 lít SO2 (đktc)
(3) Thể tích của 0,6 mol O3 ; 8g SO3 ở ( đktc)
Ai giúp mk với ạ. Cảm ơn trước 🌟