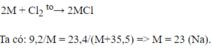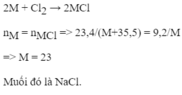NM
Những câu hỏi liên quan
Cho một luồng khí clo dư tác dụng với 9,2 gam kim loại sinh ra 23,4 gam muối của kim loại có hoá trị I. Hãy xác định tên của kim loại.
- Gọi kí hiệu và nguyên tử khối của kim loại là M.
Phương trình hoá học :
2M + Cl 2 → 2MCl
9,2 x 2(M + 35,5) = 2M x 23,4
653,2 = 28,4M
M = 23. Vậy kim loại M là kim loại natri (Na).
Đúng 2
Bình luận (0)
Cho một luồng khí clo dư tác dụng với 9,2 gam kim loại sinh ra 23,4 gam muối kim loại M hoá trị I. Muối kim loại hoá trị I là muối nào sau đây ?
A. NaCl
B. KCl
C. LiCl
D. Kết quả khác
Đáp án A
2M + Cl2 → 2MCl
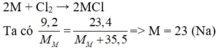
Vậy muối là NaCl.
Đúng 0
Bình luận (0)
Cho luồng khí clo (dư) tác dụng với 9,2g kim loại hóa trị I, tạo ra 23,4 g muối. Xác định tên kim loại (Na=23, Ag=108, Li=7, K=39, Cl=35,5).
9,2 gam kim loại A phản ứng với khí clo thu được 23,4 gam muối duy nhất.Biết rằng A có hóa trị 1,hãy xác định tên kim loại A
HD:
2A + Cl2 \(\rightarrow\) 2ACl
9,2 m 23,4 (g)
Áp dụng ĐL BTKL ta có: m = 23,4 - 9,2 = 14,2 gam.
Như vậy số mol của A = 2 x số mol của Cl2 = 0,4 mol. Suy ra: A = 9,2/0,4 = 23 (Na).
Đúng 0
Bình luận (0)
A có hóa trị I nên công thức của muối clorua là ACl
PTHH: 2A + Cl2 → 2Acl
Theo định luật bảo toàn khối lượng ta có:
mCl2 = mmuối – mkim loại = 23,4 - 9,2 = 14,2
=>nCl2 = 14,2/71 = 0,2 mol
Theo phương trình hóa học => nA = 2 nCl2 = 0,4 mol
Suy ra 0,4.A = 9,2. Vậy А = 23 (Na).
Đúng 0
Bình luận (0)
Cho luống khí clo dư tác dụng với 9,2 gam kim loại sinh ra 23,4g muối kim loại hóa trị I. Xác định công thức hóa học của muối đó (Na=23, Ag=108, Li=7, K=39, Cl=35,5).
Cho 9,2 gam một kim loại A phản ứng với khí clo dư tạo thành 23,4 gam muối. Hãy xác định kim loại A, biết rằng A có hoá trị I.
Lời giải:
= mmuối – mkim loại = 23,4 - 9,2 - 14,2 gam hay 14,2 : 71 = 0,2 mol
Số mol А = 2.số mol = 0,4 mol, suy ra 0,4.A = 9,2; А = 23 (Na).
Đúng 3
Bình luận (0)
PTHH : 2A+ Cl2 \(\rightarrow\) 2ACl
Áp dụng bảo toàn khối lượng ta có :
\(m_{Cl_2}\) = 23,4-9,2 =14,2g
\(n_{Cl_2}\) =14,2 :35,5x2 0,2 mol
\(\Rightarrow n_A\) =0,4 mol
n.M=m \(\Rightarrow\) M=9,2 :0,4 =23 \(\Rightarrow\) A Là Na
Đúng 0
Bình luận (0)
a---------------a
m A=a*A=9,2
M ACl=a*(A+35,5)=23,4
----->a=0,4
A=23---->Na
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Cho 9,2 gam một kim loại A phản ứng với khí clo dư tạo thành 23,4 gam muối. Hãy xác định kim loại A, biết rằng A có hoá trị I.
= mmuối – mkim loại = 23,4 - 9,2 - 14,2 gam hay 14,2 : 71 = 0,2 mol
Số mol А = 2.số mol = 0,4 mol, suy ra 0,4.A = 9,2; А = 23 (Na).
Đúng 0
Bình luận (0)
Gọi khối lượng mol của kim loại A là M(g)
PTHH: 2A +Cl2 -> 2ACl
2M gam 2(M+35,5) gam
9,2 gam 23,4 gam
⇔46,8M = 2(M+35,5).9,2
⇔46,8M = 18,4M + 653,2
⇔28,4M = 653,2
⇔M = 23
Vậy kim loại A là Na.
Đúng 0
Bình luận (0)
A có hóa trị I nên công thức của muối clorua là ACl
PTHH: 2A + Cl2 → 2Acl
Theo định luật bảo toàn khối lượng ta có:
mCl2 = mmuối – mkim loại = 23,4 - 9,2 = 14,2
=>nCl2 = 14,2/71 = 0,2 mol
Theo phương trình hóa học => nA = 2 nCl2 = 0,4 mol
Suy ra 0,4.A = 9,2. Vậy А = 23 (Na).
Đúng 0
Bình luận (0)
Cho 1 luồng khí Cl2 dư tác dụng với 9,2 g kim loại thu được 23,4 g muối clorua của kim loại hóa trị I. Tìm tên kim loại trên.
Gọi kim loại cần tìm là R
$2R + Cl_2 \xrightarrow{t^o} 2RCl$
Theo PTHH :
$n_R = n_{RCl}$
$\Rightarrow \dfrac{9,2}{R} = \dfrac{23,4}{R + 35,5}$
$\Rightarrow R = 23(Natri)$
Vậy kim loại cần tìm là Natri
Đúng 3
Bình luận (0)
cho luồng khí CLo dư tác dụng vs 9,2g Kim loại sinh ra 23,4g một kim loại. xác định công thức hóa học của muối
Đặt M là KHHH của kim loại hoá trị I.
PTHH: 2M + Cl2 → 2MCl
2M(g) (2M + 71)g
9,2g 23,4g
Ta có: 23,4 x 2M = 9,2(2M + 71)
Suy ra: M = 23.
Kim loại có khối lượng nguyên tử bằng 23 là Na.
Vậy muối thu được là: NaCl
Đúng 1
Bình luận (0)