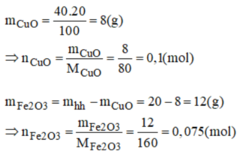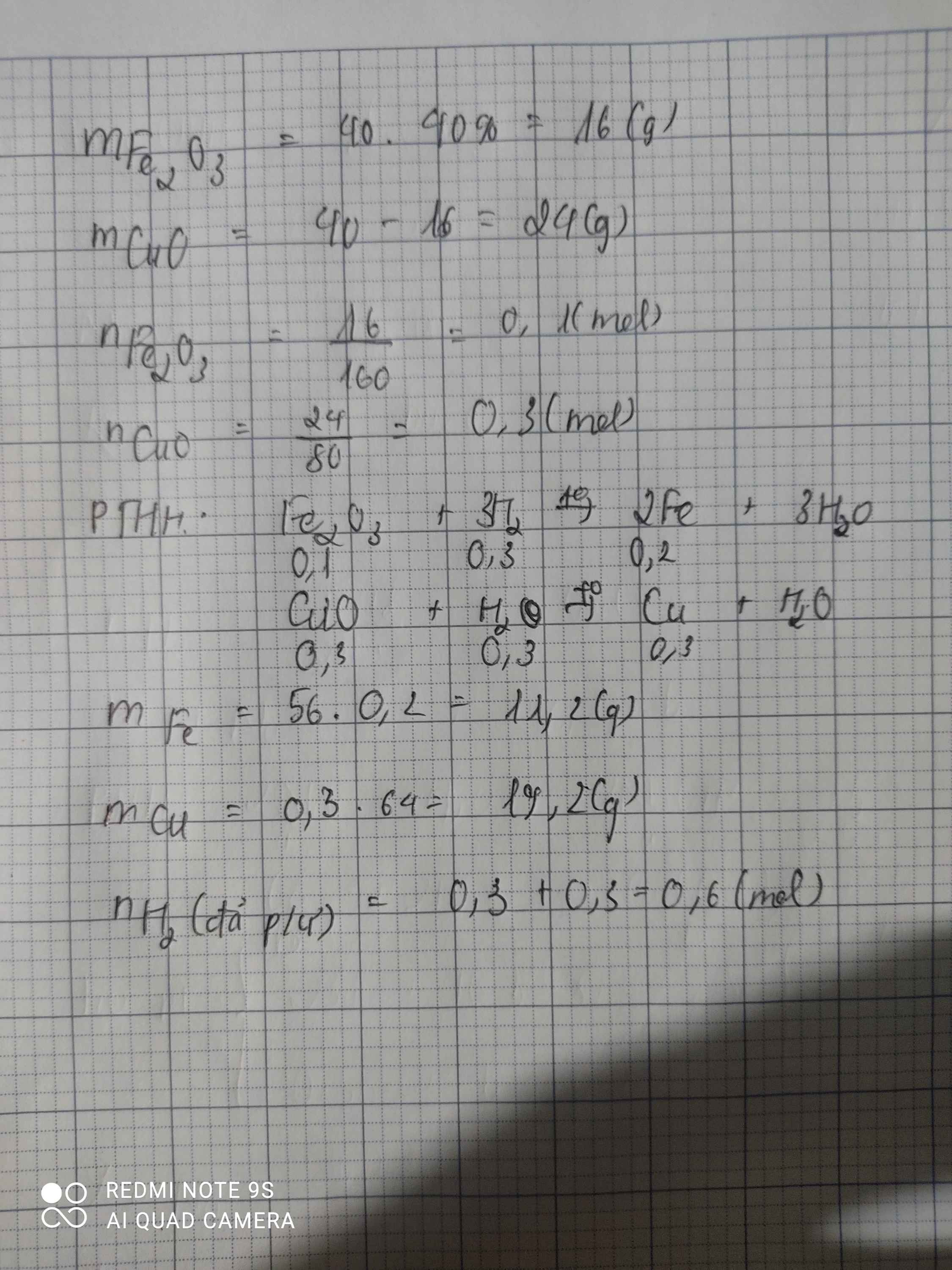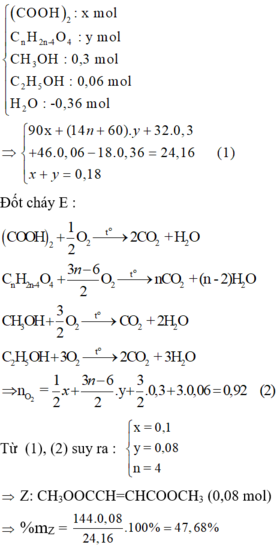Có một hỗn hợp gồm 60% F e 2 O 3 và 40% CuO. Người ta dùng H 2 ( dư) để khử 20g hỗn hợp đó. Tính khối lượng Fe và khối lượng Cu thu được sau phản ứng.
NN
Những câu hỏi liên quan
Có một hỗn hợp gồm 60% F e 2 O 3 và 40% CuO. Người ta dùng H 2 ( dư) để khử 20g hỗn hợp đó. Tính số mol H 2 tham gia phản ứng.
có 40g hỗn hợp gồm 40% Fe2O3 và 60% CuO người ta dùng h2 ( dư) để khử hỗn hợp đó . a, Tính klg Fe và Cu thu đc sau phản ứng b, Tính số mol H2 đã tham gia phản ứng
Người ta dùng khí hidro dư để khử 20 một hỗn hợp gồm 60% Fe2 O3 và 40% CuO. A.tính khối lượng các kim loại thu đc sau phản ứng B. Tính thể tích khí hidro cần dùng (ở đktc)
Xem chi tiết
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
a, Ta có: \(\left\{{}\begin{matrix}m_{Fe_2O_3}=20.60\%=12\left(g\right)\Rightarrow n_{Fe_2O_3}=\dfrac{12}{160}=0,075\left(mol\right)\\m_{CuO}=20-12=8\left(g\right)\Rightarrow n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\end{matrix}\right.\)
Theo pT: \(\left\{{}\begin{matrix}n_{Fe}=2n_{Fe_2O_3}=0,15\left(mol\right)\\n_{Cu}=n_{CuO}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
\(m_{Cu}=0,1.64=6,4\left(g\right)\)
b, Theo PT: \(n_{H_2}=3n_{Fe_2O_3}+n_{CuO}=0,325\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,325.22,4=7,28\left(l\right)\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
Có một hỗn hợp gồm 60% Fe2O3 và 40% CuO . Người ta dùng H2 ( dư ) để khử 20 gam hỗn hợp đó.
a) Tính khối lượng Fe và khối lượng Cu thu được sau phản ứng.
b) Tính số mol H2 đã tham gia phản ứng
Khối lượng Fe2O3 trong 20 gam hỗn hợp : \(20\cdot\dfrac{60}{100}=12\left(g\right)\)
\(\Rightarrow n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{12}{160}=0,075\left(mol\right)\)
Khối lượng CuO trong 20 gam hỗn hợp : \(\dfrac{20\cdot40}{100}=8\left(g\right)\)
\(\Rightarrow n_{CuO}=\dfrac{m}{M}=\dfrac{8}{80}=0,1\left(mol\right)\)
Phương trình phản ứng khử của H2 :
Fe2O3 + 3H2 \(\rightarrow\)2Fe + 3H2O
1---------3---------2
0,075-----0,225---0,15
Theo phương trình phản ứng trên , ta có : mFe = 0,15 . 56 = 8,4 ( g )
CuO + H2 \(\rightarrow\) Cu + H2O
1--------1------1
0,1------0,1-----0,1
Theo phương trình phản ứng trên : mCu = 0,1 . 64 = 6,4 ( gam )
a) Khối lượng Fe : 8,4 ( gam ) ; Khối lượng của Cu : 6,4 gam
b) Số mol H2 đã tham gia phản ứng : 0,225 + 0,1 = 0,325 ( mol )
Đúng 1
Bình luận (0)
\(m_{Fe_2O_3}=60\%.20=12\left(g\right)\)
\(n_{Fe_2O_3}=\dfrac{12}{160}=0,075\left(mol\right)\)
\(m_{CuO}=40\%.20=8\left(g\right)\)
\(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
Pt: \(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,075mol\(\rightarrow\)0,225mol\(\rightarrow\) 0,15mol
Pt: CuO + H2 \(\rightarrow\) Cu + H2O
0,1mol\(\rightarrow\)0,1mol\(\rightarrow\)0,1mol
a) \(m_{Fe}=0,15.56=8,4\left(g\right)\)
\(m_{Cu}=0,1.64=6,4\left(g\right)\)
b) \(n_{H_2\left(pư\right)}=0,225+0,1=0,325\left(mol\right)\)
Đúng 1
Bình luận (0)
a , PTHH :
Fe2O3 + 3H2 -> 2Fe + 3H2O
0,075......0,225.........0,15 (mol)
CuO + H2 -> Cu + H2O
0,1.......0,1......0,1 (mol)
mFe2O3 = 20.60%=12(g) => nFe2O3 = 0,075(mol)
mCuO = 8 ( g) => nCuO = 0,1(mol)
mFe = 0,15 .56=8,4(g)
mCu = 0,1 .64=6,4(g)
b , Tổng số mol H2 đã tham gia phản ứng là :
\(\Sigma n_{H2}=0,225+0,1=0,325\left(mol\right)\)
Đúng 0
Bình luận (0)
cho hỗn hợp gồm 60% FE2O3 và 40% CuO người ta dùng H2 để khử 20g hỗn hợp đó. tính khối lượng sắt và đồng thu dc sau phản ứng và tính số mol H2 phản ứng
giúp tôi
hỗn hợp 100% <=> 20g
1. fe2o3 60% <=> 12g <=> 0,075mol
cuo 40% <=> 8g <=> 0,1 mol
Ta có:
Fe2O3 + 3H2 --> 2Fe + 3H2O
mol: 0,075 0,225 0,15
CuO + H2 → Cu + H20
mol: 0.1 0.1 0.1
mFe= 0,15x56=8,4g. mCu=0,1x64= 6,4g
nH2= 0,225+0,1=0,325mol ==> V H2 = 0,325x 22,4 = 7,28 lít
Đúng 1
Bình luận (0)
X, Y, Z là 3 este đều hai chức, mạch hở (trong đó X, Y đều no; Z không no chứa một nối đôi CC). Đun nóng 24,16 gam hỗn hợp E chứa X, Y, Z với 120 gam dung dịch NaOH 12% (vừa đủ), thu được hỗn hợp chứa 2 muối và hỗn hợp F gồm 2 ancol đều đơn chức hơn kém nhau một nguyên tử cacbon. Đun F với CuO thu được hỗn hợp gồm 2 anđehit, rồi cho tác dụng với dung dịch AgNO3/NH3 (dư) thu được 142,56 gam Ag. Mặt khác đốt cháy 24,16 gam E cần dùng 0,92 mol O2. Phần trăm khối lượng của Z trong hỗn hợp E là A. 52...
Đọc tiếp
X, Y, Z là 3 este đều hai chức, mạch hở (trong đó X, Y đều no; Z không no chứa một nối đôi C=C). Đun nóng 24,16 gam hỗn hợp E chứa X, Y, Z với 120 gam dung dịch NaOH 12% (vừa đủ), thu được hỗn hợp chứa 2 muối và hỗn hợp F gồm 2 ancol đều đơn chức hơn kém nhau một nguyên tử cacbon. Đun F với CuO thu được hỗn hợp gồm 2 anđehit, rồi cho tác dụng với dung dịch AgNO3/NH3 (dư) thu được 142,56 gam Ag. Mặt khác đốt cháy 24,16 gam E cần dùng 0,92 mol O2. Phần trăm khối lượng của Z trong hỗn hợp E là
A. 52,31%
B. 47,68%
C. 35,76%
D. 39,24%
Định hướng tư duy giải
Ta có:
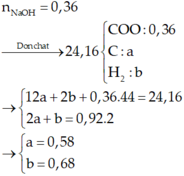
Vì các este đều 2 chức
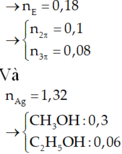
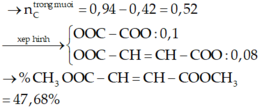
Đúng 0
Bình luận (0)
X, Y, Z là 3 este đều hai chức, mạch hở đều được tạo thành từ các axit cacboxylic chỉ có nhóm -COOH và ancol (trong đó X, Y đều no; Z không no chứa một nối đôi CC). Đun 24,16 gam hỗn hợp E chứa X, Y, Z với 120 gam dung dịch NaOH 12% (vừa đủ), thu được hỗn hợp chứa 2 muối và hỗn hợp F gồm 2 ancol đều đơn chức hơn kém nhau một nguyên tử cacbon. Đun F với CuO thu được hỗn hợp gồm 2 anđehit, rồi cho tác dụng với dung dịch AgNO3/NH3 (dư) thu được 142,56 gam Ag. Mặt khác đốt cháy 24,16 gam E cần dùng...
Đọc tiếp
X, Y, Z là 3 este đều hai chức, mạch hở đều được tạo thành từ các axit cacboxylic chỉ có nhóm
-COOH và ancol (trong đó X, Y đều no; Z không no chứa một nối đôi C=C). Đun 24,16 gam hỗn hợp E chứa X, Y, Z với 120 gam dung dịch NaOH 12% (vừa đủ), thu được hỗn hợp chứa 2 muối và hỗn hợp F gồm 2 ancol đều đơn chức hơn kém nhau một nguyên tử cacbon. Đun F với CuO thu được hỗn hợp gồm 2 anđehit, rồi cho tác dụng với dung dịch AgNO3/NH3 (dư) thu được 142,56 gam Ag. Mặt khác đốt cháy 24,16 gam E cần dùng 0,92 mol O2. Phần trăm khối lượng của Z trong hỗn hợp E là:
A. 52,31%
B. 47,68%
C. 35,76%
D. 39,24%
Mọi người ơi cho mình hỏi bài này làm sao ạ hỗn hợp X gồm CuO và FexOy ( trong đó kim loại chiếm 76% về khối lượng). Người ta dùng CO dư để khử hoàn toàn m1 gam X ở nhiệt độ cao, sau phản ứng thu được chất rắn Y gồm 2 kim loại và hỗn hợp khí z ( có khối lượng nặng hơn khối lượng CO ban đầu là 9,6 gam). Cho Y tác dụng với dung dịch HCl dư thu được 4,48 lít H2( ở đktc) và có m2 gam chất rắn không tan.a. Tính m1? m2?b. Xác định công thức hóa học của FexOyAi giúp đỡ mình giải bài mình cảm ơn nhiều n...
Đọc tiếp
Mọi người ơi cho mình hỏi bài này làm sao ạ
hỗn hợp X gồm CuO và FexOy ( trong đó kim loại chiếm 76% về khối lượng). Người ta dùng CO dư để khử hoàn toàn m1 gam X ở nhiệt độ cao, sau phản ứng thu được chất rắn Y gồm 2 kim loại và hỗn hợp khí z ( có khối lượng nặng hơn khối lượng CO ban đầu là 9,6 gam). Cho Y tác dụng với dung dịch HCl dư thu được 4,48 lít H2( ở đktc) và có m2 gam chất rắn không tan.
a. Tính m1? m2?
b. Xác định công thức hóa học của FexOy
Ai giúp đỡ mình giải bài mình cảm ơn nhiều nghen!
1)
Phần trăm O trong oxit là 100% -76% = 24%
$CO + O_{oxit} \to CO_2$
Ta thấy :
m khí tăng = m O(oxit) = 9,6(gam)
=> m1 = 9,6/24% = 40(gam)
n O(oxit) = 9,6/16 = 0,6(mol)
Bảo toàn khối lượng :
m kim loại = m oxit - m O = 40 - 0,6.16 = 30,4(gam)
$Fe + 2HCl \to FeCl_2 + H_2$
n Fe = n H2 = 4,48/22,4 = 0,2(mol)
=> m Cu = m 2 = 30,4 - 0,2.56 = 19,2(gam)
b)
n CuO = n Cu = 19,2/64 = 0,3(mol)
Ta có :
n O(trong oxit sắt) = n O(oxit) - n O(trong CuO) = 0,6 -0,3 = 0,3(mol)
Ta thấy :
n Fe : n O = 0,2 : 0,3 = 2 : 3
Vậy oxit cần tìm là Fe2O3
Đúng 4
Bình luận (1)
Dùng H2 khử 31.2g hỗn hợp CuO và Fe3O4 trong hỗn hợp Khối Lượng Fe3O4 hơn CuO 15.2g Tính Khối Lượng CU và Fe thu đc
giúp mình với
Goi x la so gam cua CuO
x+15,2 la so gam cua Fe3O4
Ta co x+(x+15,2)=31,2 =>x=8
mCuO=8g=>n=0,1mol
mFe3O4=23,2g=>n=0,1 mol
CuO + H2-->Cu+ H2O
0,1 0,1
Fe3O4+4H2O--->Fe+H2O
0,1 0,1
mCu=0,1.64=6,4g
mFe=0,1.56=5,6g
Đúng 0
Bình luận (0)
Sorry
Chinh sua lai cho phuong trinh
Fe3O4 +4H2--> 3Fe+4H2O
0,1 0,3
mFe=0,3.56=16,8
Co chut sai sot hihi sorry
Đúng 3
Bình luận (0)