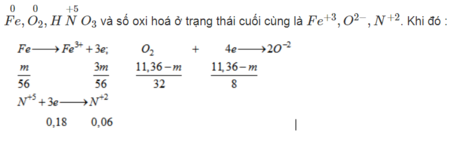
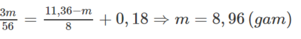Cho 11,36 gam hỗn hợp Fe, FeO, F e 2 O 3 v à F e 3 O 4 phản ứng hết với dung dịch HNO3 dư thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối. Giá trị của m là
A. 38,72
B. 35,5
C. 49,09
D. 35,36