Hãy tìm công thức hóa học của một hợp chất có thành phần theo khối lượng là 36,8% Fe; 21,0% S; 42,2% O. Biết khối lượng mol của hợp chất bằng 152 g/mol.
NN
Những câu hỏi liên quan
Hãy tìm công thức hóa học của một hợp chất có thành phần theo khối lượng là 36,8% Fe; 21,0% S; 42,2% O. Biết khối lượng mol của hợp chất bằng 152 g/mol
Khối lượng mol của Fe là MFe = = 56 g
Khối lượng mol của S là: MS = = 32 g
Khối lượng mol của O là: MO = = 64 g
Gọi công thức hóa học của hợp chất là FeXSyOz, ta có:
56 . x = 56 => x = 1
32 . y = 32 => y = 1
16 . z = 64 => z = 4
Vậy hợp chât có công thức hóa học là FeSO4
Đúng 0
Bình luận (0)
Khối lượng mol của Fe là \(M_{Fe}\) = (152 . 36,8)/100 = 56 g
Khối lượng mol của S là: \(M_S\) = (152 . 21)/100 = 32 g
Khối lượng mol của O là: \(M_O\) = (152 . 42,2)/100 = 64 g
Gọi công thức hóa học của hợp chất là \(Fe_xS_yO_z\), ta có:
\(56.x=56\Rightarrow x=1\)
\(32.y=32\Rightarrow y=1\)
\(16.z=64\Rightarrow z=4\)
Vậy hợp chât có công thức hóa học là \(FeSO_4\)
Đúng 0
Bình luận (0)
1.Tính thành phần phần trăm (theo khối lượng) của các nguyên tố hóa học có mặt trong các hợp chất sau:a) Fe(NO3)2, Fe(NO3)2b) N2O, NO, NO22.Hãy tìm công thức hóa học của chất X có khối lượng mol MX 170 (g/mol), thành phần các nguyên tố theo khối lượng: 63,53% Ag; 8,23% N, còn lại O.3.Lập công thức hóa học của hợp chất A biết:- Phân khối của hợp chất là 160 đvC-Trong hợp chất có 70% theo khối lượng sắt, còn lại là oxi.
Đọc tiếp
1.Tính thành phần phần trăm (theo khối lượng) của các nguyên tố hóa học có mặt trong các hợp chất sau:
a) Fe(NO3)2, Fe(NO3)2
b) N2O, NO, NO2
2.Hãy tìm công thức hóa học của chất X có khối lượng mol MX = 170 (g/mol), thành phần các nguyên tố theo khối lượng: 63,53% Ag; 8,23% N, còn lại O.
3.Lập công thức hóa học của hợp chất A biết:
- Phân khối của hợp chất là 160 đvC
-Trong hợp chất có 70% theo khối lượng sắt, còn lại là oxi.
Câu 2:
Trong 1 mol X: \(\left\{{}\begin{matrix}n_{Ag}=\dfrac{170.63,53\%}{108}=1\left(mol\right)\\n_N=\dfrac{170.8,23\%}{14}=1\left(mol\right)\\n_O=\dfrac{170\left(100\%-63,53\%-8,23\%\right)}{16}=3\left(mol\right)\end{matrix}\right.\)
Vậy CTHH của X là \(AgNO_3\)
Đúng 2
Bình luận (0)
Câu 1:
\(a,\%_{Fe}=\dfrac{56}{180}\cdot100\%=31,11\%\\ \%_N=\dfrac{14\cdot2}{180}\cdot10\%=15,56\%\\ \%_O=100\%-31,11\%-15,56\%=53,33\%\\ b,\%_{N\left(N_2O\right)}=\dfrac{14\cdot2}{44}\cdot100\%=63,63\%\\ \%_{O\left(N_2O\right)}=100\%-63,63\%=36,37\%\\ \%_{N\left(NO\right)}=\dfrac{14}{30}\cdot100\%=46,67\%\\ \%_{O\left(NO\right)}=100\%-46,67\%=53,33\%\\ \%_{O\left(NO_2\right)}=\dfrac{16\cdot2}{46}\cdot100\%=69,57\%\\ \%_{N\left(NO_2\right)}=100\%-69,57\%=30,43\%\)
Đúng 2
Bình luận (0)
Hãy tìm công thức hóa học của một hợp chất có thành phần theo khối lượng là 36,8% Fe; 21,0% S; 42,2% O. Biết khối lượng mol của hợp chất bằng 152 g/mol
Khối lượng mol của Fe là MFe = = 56 g
Khối lượng mol của S là: MS = = 32 g
Khối lượng mol của O là: MO = = 64 g
Gọi công thức hóa học của hợp chất là FeXSyOz, ta có:
56 . x = 56 => x = 1
32 . y = 32 => y = 1
16 . z = 64 => z = 4
Vậy hợp chât có công thức hóa học là FeSO4
Đúng 0
Bình luận (2)
Khối lượng mol của Fe là MFe = = 56 g
Khối lượng mol của S là: MS = = 32 g
Khối lượng mol của O là: MO = = 64 g
Gọi công thức hóa học của hợp chất là FeXSyOz, ta có:
56 . x = 56 => x = 1
32 . y = 32 => y = 1
16 . z = 64 => z = 4
Vậy hợp chât có công thức hóa học là FeSO4
Đúng 0
Bình luận (1)
Trong hợp chất 1 mol có khối lượng của từng nguyên tố là :
\(m_{Fe}=\dfrac{152.36,8}{100}=56\) \(g\)
\(m_S=\dfrac{152.21}{100}=32\) \(g\)
\(m_O=\dfrac{152.42,2}{100}=64\) \(g\)
Gọi CTHH của hợp chất là \(Fe_xS_yO_z\) , ta có :
\(56.x=56\Rightarrow x=1\)
\(32.y=32\Rightarrow y=1\)
\(16.2=64\Rightarrow z=4\)
Vậy hợp chất có CTHH là \(FeSO_4\)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Một loại phân bón hóa học có công thức là KNO3, em hãy xác định thành phần% ( theo khối lượng) của các nguyên tố.
Một hợp chất A có thành phần các nguyên tố là: 80%Cu; 20%O. Em hãy xác định công thức hóa học của hợp chất đó. Biết hợp chất có khối lượng mol là 80 gam/mol.
\(PTK_{KNO_3}=101\left(đvC\right)\\ \Leftrightarrow\left\{{}\begin{matrix}\%_K=\dfrac{39}{101}\cdot100\%=38,61\%\\\%_N=\dfrac{14}{101}\cdot100\%=13,86\%\\\%_O=100\%-38,61\%-13,86\%=47,53\%\end{matrix}\right.\)
Trong hợp chất:
\(\left\{{}\begin{matrix}m_{Cu}=80\cdot80\%=64\left(g\right)\\m_O=80\cdot20\%=16\left(g\right)\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}n_{Cu}=\dfrac{64}{64}=1\left(mol\right)\\n_O=\dfrac{16}{16}=1\left(mol\right)\end{matrix}\right.\)
Vậy CTHH A là \(CuO\)
Đúng 0
Bình luận (0)
Một hợp chất có công thức hóa học là K2CO3. Em hãy cho biết:
a) Khối lượng mol của chất đã cho.
b) Thành phần phần trăm (theo khối lượng) của các nguyên tố có trong hợp chất.
a) MK2CO3 = 39.2 + 12 + 16.3 = 138 (g)
b)
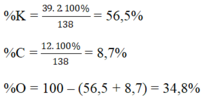
Đúng 0
Bình luận (0)
Biết một hợp chất có khối lượng mol là 400 g/mol và có thành phần theo khối lượng của các nguyên tố như sau: 28% Fe; 24% S còn lại là O. Xác định công thức hóa học của hợp chất trên.
\(m_{Fe}=\%Fe.M_X=28\%.400=112\left(g\right)\\ m_S=\%S.M_X=24\%.400=96\left(g\right)\\ m_O=m_X-m_{Fe}-m_S=400-112-96=192\left(g\right)\)
\(\Rightarrow n_{Fe}=\dfrac{m}{M}=\dfrac{112}{56}=2\left(mol\right)\)
\(m_S=\dfrac{m}{M}=\dfrac{96}{32}=3\left(mol\right)\)
\(m_O=\dfrac{m}{M}=\dfrac{192}{16}=12\left(mol\right)\)
\(CTHH:Fe_2\left(SO_4\right)_3\)
Đúng 1
Bình luận (2)
\(m_{Fe}=\dfrac{28.400}{100}=112g\\ m_S=\dfrac{24.400}{100}=96g\\ m_O=400-112-96=192g\\ \Rightarrow n_{Fe}=\dfrac{112}{56}=2mol\\ n_S=\dfrac{96}{32}=3mol\\ n_O=\dfrac{192}{16}=12\\ CTHH:Fe_2S_3O_{12}\)
Đúng 1
Bình luận (4)
Một hợp chất hóa học có công thức là CaCO3 Em hãy xác định thành phần phần trăm theo khối lượng của nguyên tố
\(\%Ca=\dfrac{1.40}{100}.100\%=40\%\\\%C=\dfrac{1.12}{100}.100\%=12\%\\ \%O=100\%-\left(40\%+12\%\right)=48\% \)
Đúng 0
Bình luận (0)
MCaCO3 = 100 g/mol
%Ca = \(\dfrac{40}{100}.100\)= 40%
%C = \(\dfrac{12}{100}.100\)= 12%
%O3= \(\dfrac{48}{100}.100\)=48%
Đúng 2
Bình luận (0)
Hợp chất X được tạo thành bởi Fe và O có khối lượng phân tử là 160. Biết phần trăm khối lượng của Fe trong X là 70%. Hãy xác định công thức hóa học của X
Gọi CTTQ của hợp chất X là: FexOy.
Ta có:
\(M_{Fe_xO_y}=160\left(amu\right)\)
\(\%m_{Fe}=70\%\Rightarrow\%m_O=100\%-70\%=30\%\)
\(x=\dfrac{\%m_{Fe}
.
M_{Fe_xO_y}}{M_{Fe}}=\dfrac{70\%
.
160}{56}=2\)
\(y=\dfrac{\%m_O
.
M_{Fe_xO_y}}{M_O}=\dfrac{30\%
.
160}{16}=3\)
Vậy CTHH của hợp chất X là Fe2O3.
Đúng 1
Bình luận (0)
Một hợp chất khí có thành phần phần trăm theo khối lượng là 82,35% N và 17,65% H. Em hãy cho biết: Công thức hóa học của hợp chất. Biết hợp chất này có tỉ khối đối với khí hidro là 8,5.
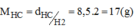
Khối lượng của nito trong 1 mol hợp chất:
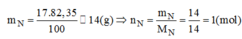
Khối lượng của hidro trong 1 mol hợp chất:
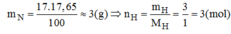
Vậy trong hợp chất có 1 mol nguyên tử N và 3 mol nguyên tử H.
→ Công thức hóa học đơn giản của hợp chất là N H 3
Đúng 1
Bình luận (0)







