Nhiệt phân hoàn toàn 2,45 g K C l O 3 thu được O 2 . Cho Zn tác dụng hết với vừa thu được, tính khối lượng oxit thu được sau phản ứng?
A. 2,45 g
B. 5,4 g
C. 4,86 g
D. 6,35 g
Nhiệt phân hoàn toàn 4,86g Ca(HCO3)2. Sau phản ứng thu được V(l) khí CO2 (dktc). Tìm V. (Ca = 40; H = 1; C = 12; O = 16).
`Ca(HCO_3)_2->CaCO_3+H_2O+CO_2` (to)
0,03---------------------------------------------0,03 mol
`n(Ca(HCO_3)_2) =(4,86)/162=0,03 mol`
`=>V_(CO_2)=0,03.22,4=0,672l`
Nhiệt phân hoàn toàn 12,25g KCIO3 thu được bao nhiêu lít khí oxi(ở dktc)?
(Biết K=39;O=16;Cl=35,5)
\(n_{KClO_3}=\dfrac{12,25}{122,5}=0,1mol\)
\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,1 0,15 ( mol )
\(V_{O_2}=0,15.22,4=3,36l\)
nKClO3 = 12,25 : 122,5 = 0,1 (mol)
pthh : 2KClO3 -t--> 2KCl + 3O2
0,1 --------------------->0,15 (mol)
=> VO2(dktc) = 0,15 . 22,4 = 3,36 ( l)
Đốt cháy hoàn toàn 0,1 mol chất hữu cơ X (C, H, O, N) cần 3 mol không khí (gồm N2 và O2, trong đó N2 chiếm 80% về thể tích) thu được 0,5 mol CO2, 0,6 mol H2O và 2,45 mol N2. X có công thức phân giống với công thức phân tử của:
A. Glixin
B. Axit glutamic
C. Valin
D. Alanin
Đáp án B
Trong 3 mol không khí có n N 2 = 2 , 4 ⇒ n N ( X ) = 0 , 05 . 2 = 0 , 1
Có 1 nhóm NH2
Số mol oxi trong X là = 0,5.2 + 0,6 - 3.20%:2 = 0,4 mol
Dó đó có 4 oxi trong X
X là C5H12O4N
Suy ra X gần giống với công thức phân tử C5H9O4N
a) Nhiệt phân m gam KMnO4 thu được 11,2 lít khí oxi (đktc). Tính m. (K = 39; Mn = 55; O = 16)
b) Khử hoàn toàn 80 gam Fe2O3 bằng V lít (đktc) khí hiđro ở nhiệt độ cao. Tính V. ( Fe = 56; O = 16)
c) Cho 8 gam bột CuO tác dụng với 1,12 lít khí H2 (đktc) ở nhiệt độ cao. (O = 16; Cu = 64)
- Chất nào còn dư sau phản ứng và dư là bao nhiêu mol?
- Tính khối lượng chất rắn và thể tích chất khí (đktc) thu được sau phản ứng.
a) \(n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
1<-----------------------------0,5
=> \(m_{KMnO_4}=1.158=158\left(g\right)\)
b) \(n_{Fe_2O_3}=\dfrac{80}{160}=0,5\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,5--->1,5
=> \(V_{H_2}=1,5.22,4=33,6\left(l\right)\)
c) \(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,05}{1}\) => CuO dư, H2 hết
PTHH: CuO + H2 --to--> Cu + H2O
0,05<-0,05---->0,05-->0,05
=> \(n_{Cu\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\)
mCu = 0,05.64 = 3,2 (g)
VH2O = 0,05.22,4 = 1,12 (l)
a)\(n_{O_2}=\dfrac{11,2}{22,4}=0,5mol\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
1 0,5
\(M_{KMnO_4}=1\cdot158=158g\)
b)\(n_{Fe_2O_3}=\dfrac{80}{160}=0,5mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,5 1,5
\(V_{H_2}=1,15\cdot22,4=25,76l\)
Nhiệt phân hoàn toàn 24,5 gam KClO3 thu được KCl và khí O2.
a) Tính thể tích khí O2 thu được (đkc).
b) Cho toàn bộ khí O2 trên tác dụng với 32 gam Cu.
- Sau phản ứng, chất nào còn dư? Dư bao nhiêu gam?
- Tính khối lượng CuO thu được. Cho NTK: K=39, O=16; Cu = 64, Cl = 35,5.
a, PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Ta có: \(n_{KClO_3}=\dfrac{24,5}{122,5}=0,2\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{2}n_{KClO_3}=0,3\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,3.24,79=7,437\left(g\right)\)
b, PT: \(2Cu+O_2\underrightarrow{t^o}2CuO\)
Ta có: \(n_{Cu}=\dfrac{32}{64}=0,5\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,5}{2}< \dfrac{0,3}{1}\), ta được O2 dư.
Theo PT: \(\left\{{}\begin{matrix}n_{O_2\left(pư\right)}=\dfrac{1}{2}n_{Cu}=0,25\left(mol\right)\\n_{CuO}=n_{Cu}=0,5\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{O_2\left(dư\right)}=0,3-0,25=0,05\left(mol\right)\)
\(\Rightarrow m_{O_2\left(dư\right)}=0,05.32=1,6\left(g\right)\)
\(m_{CuO}=0,5.80=40\left(g\right)\)
Nhiệt phân hoàn toàn 15,8g KMnO4 thu được bao nhiêu lít khí oxi ở điều kiện tiêu chuẩn? (K=39, Mn=55, O=16)
A. 1,12 lít B. 2,24 lít C. 3,36 lít D. 4,48 lít
\(n_{KMnO_4}=\dfrac{15,8}{158}=0,1mol\)
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,1 0,05 ( mol )
\(V_{O_2}=0,05.22,4=1,12l\)
-->A
\(n_{KMnO_4}=\dfrac{m}{M}=\dfrac{15,8}{158}=0,1mol\)
\(PTHH:2KMnO_4\underrightarrow{t^o}MnO_2+O_2+K_2MnO_4\)
\(2:1:1:1\) \(\left(mol\right)\)
\(0,1:0,05:0,05:0,05\) \(\left(mol\right)\)
\(V_{O_2}=n.22,4=0,05.22,4=1,12l\)
Chọn A
Bài 1: Nhiệt phân hoàn toàn 47,4 gam KMnO\(_4\) sau phản ứng thu được hỗn hợp các chất rắn gồm K\(_2\)MnO\(_4\), MnO\(_2\) và khí O\(_2\). Cho toàn bộ khối lượng 0\(_2\) thu được ở trên tác dụng hết với Fe, tính khối lượng oxit sắt từ thu được sau phản ứng.
Bài 2: Nguời ta điều chế 3,36 lít khí oxi ( ở đktc ) bằng cách nung nóng kaliclorat ( KClO\(_3\) ) có chất xúc tác. Nếu dùng thể tích O\(_2\) trên để đốt hoàn toàn một lượng Mg thì thu được bao nhiêu gam MgO
Bài 1 :
\(2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{O_2} = \dfrac{1}{2}n_{KMnO_4} = \dfrac{1}{2}.\dfrac{47,4}{158} = 0,15(mol)\\ 3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\\ n_{Fe_3O_4} = \dfrac{1}{2}n_{O_2} = 0,075(mol)\\ m_{Fe_3O_4} = 0,075.232 = 17,4(gam)\)
\(n_{O_2} = \dfrac{3,36}{22,4} = 0,15(mol)\\ 2Mg + O_2 \xrightarrow{t^o} 2MgO\\ n_{MgO} = 2n_{O_2} = 0,15.2 = 0,3(mol)\\ m_{MgO} = 0,3.40 = 12(gam)\)
Bài 1: PTHH 1: 2\(KMnO_4\) ---> \(K_2MnO_4\) + \(MnO_2\) + \(O_2\)
0,3 mol 0,15 mol 0,15 mol 0,15 mol
+ Số mol của \(KMnO_4\)
\(n_{KMnO_4}\) = \(\dfrac{m}{M}\) = \(\dfrac{47,4}{158}\) = 0,3 (mol)
+ Số g của \(O_2\)
\(m_{O_2}\) = n . M = 0,15 . 32 = 4,8 (g)
PTHH 2: 3Fe + 2\(O_2\) ---> \(Fe_3O_4\)
0,225 mol 0,15 mol 0,075 mol
Khối lượng \(Fe_3O_4\) (sắt từ):
\(m_{Fe_3O_4}\) = n . M = 0,075 . 232 = 17,4 (g)
_______________________________________________
Đây là bài 1, có gì không đúng nhắn mình nha bạn :))
Nhiệt phân hoàn toàn 31,6 gam KMnO4 để điều chế oxi. Thể tích khí O2 thu được ở đktc là:
(K = 39; Mn = 55; O = 16)
A.8,96 lít
B.4,48 lít
C.1,12 lít
D.2,24 lít
Nhiệt phân hoàn toàn 31,6 gam KMnO4 để điều chế oxi. Thể tích khí O2 thu được ở đktc là:
(K = 39; Mn = 55; O = 16)
A.
8,96 lít
B.
4,48 lít
C.
1,12 lít
D.
2,24 lít
Tham khảo:
= 31,6/158 = 0,2 (mol)
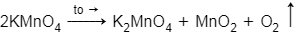
⇒ V = 0,1.22,4 = 2,24 (lít)
Phương trình nhiệt phân theo sơ đồ sau
2KMnO 4 K 2 MnO 4 + MnO 2 + O 2 .
a) Tính thể tích khí oxi (đktc) thu được khi nhiệt phân 63,2 g KMnO 4 .
b) Tính khối lượng Al 2 O 3 được tạo thành khi cho lượng khí oxi sinh ra ở trên tác dụng hết với Al.
nKMnO4 = 63,2 : 158 = 0,4( mol)
pthh : 2MKMnO4 -t--> K2MnO4 + MnO2 + O2
0,4 --------------------------------------->0,2 (mol)
-> VO2 = 0,2 .22,4 = 4,48 (L)
PTHH : 4Al + 3O2 -t--> 2Al2O3
0 ,2 -----> 2/15 (mol)
=> mAl2O3 = 2/15 . 102 = 13,6 (g)
a, \(n_{KMnO_4}=\dfrac{63,2}{158}=0,4\left(mol\right)\)
PTHH: 2KMnO4 ---to→ K2MnO4 + MnO2 + O2
Mol: 0,4 0,2
\(V_{O_2}=0,2.22,4=4,48\left(l\right)\)
b,
PTHH: 4Al + 3O2 ---to→ 2Al2O3
Mol: 0,2 0,133
\(m_{Al_2O_3}=\dfrac{2}{15}.102=13,6\left(g\right)\)