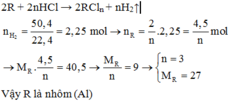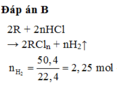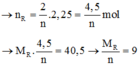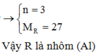Bài toán dư kim loại tác dụng axit
NT
Những câu hỏi liên quan
Bài 1: Cho các kim loại Zn,Al,Để lần lượt tác dụng với dung dịch axit HCl
a, Viết các PTHH của phản ứng
b, Cho cùng 1 khối lượng các kim loại trên tác dụng với axit dư thì kim loại nào cho nhiều khí H² nhất?
c, Nếu thu được cùng 1 thể tích khí H² thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất?
Bài 2: Cho 11,2g Fe tác dụng với dung dịch loãng có chứa 9,8g axit H²SO⁴
a, Chất nào còn dư sau phản ứng và dư bao nhiêu g?
b, Tính thể tích khí H² thu được ở đktc
- Xác định nguyên tố kim loại
Đọc tiếp
Bài 1: Cho các kim loại Zn,Al,Để lần lượt tác dụng với dung dịch axit HCl
a, Viết các PTHH của phản ứng
b, Cho cùng 1 khối lượng các kim loại trên tác dụng với axit dư thì kim loại nào cho nhiều khí H² nhất?
c, Nếu thu được cùng 1 thể tích khí H² thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất?
Bài 2: Cho 11,2g Fe tác dụng với dung dịch loãng có chứa 9,8g axit H²SO⁴
a, Chất nào còn dư sau phản ứng và dư bao nhiêu g?
b, Tính thể tích khí H² thu được ở đktc
- Xác định nguyên tố kim loại
Bài 1:
a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\) (1)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\) (2)
b, Giả sử: mZn = mAl = a (g)
\(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{Al}=\dfrac{a}{27}\left(mol\right)\end{matrix}\right.\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2\left(1\right)}=n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{H_2\left(2\right)}=n_{Al}=\dfrac{a}{27}\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2\left(1\right)}< n_{H_2\left(2\right)}\)
Vậy: Al cho nhiều khí H2 hơn.
c, Giả sử: nH2 (1) = nH2 (2) = b (mol)
Theo PT: \(\left\{{}\begin{matrix}n_{Zn}=n_{H_2\left(1\right)}=b\left(mol\right)\\n_{Al}=n_{H_2\left(2\right)}=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Zn}=65b\left(g\right)\\m_{Al}=27b\left(g\right)\end{matrix}\right.\)
\(\Rightarrow m_{Zn}>m_{Al}\)
Vậy: Khối lượng Al đã pư nhỏ hơn.
Bài 2:
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
a, Ta có: \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,1}{1}\), ta được Fe dư.
Theo PT: \(n_{Fe\left(pư\right)}=n_{H_2SO_4}=0,1\left(mol\right)\)
\(\Rightarrow n_{Fe\left(dư\right)}=0,1\left(mol\right)\Rightarrow m_{Fe\left(dư\right)}=0,1.56=5,6\left(g\right)\)
b, Theo PT: \(n_{H_2}=n_{H_2SO_4}=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (2)
Cho 2,7 gam bột kim loại nhôm tác dụng với dung dịch axit sunfuricTính thể tích khí thoát ra ở điều kiện tiêu chuẩnNếu cho lượng kim loại ở trên tác dụng với 8,1 gam axit clohiđric sau phản ứng chất nào dư ,dư bao nhiêu gam
Xem chi tiết
\(n_{Al} = \dfrac{2,7}{27} = 0,1(mol)\\ 2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\\ n_{H_2} = \dfrac{3}{2}n_{Al} = 0,15(mol)\\ \Rightarrow V_{H_2} = 0,15.22,4 = 3,36(lít)\\ n_{HCl} = \dfrac{8,1}{36,5} = \dfrac{81}{365}(mol)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ \dfrac{n_{Al}}{2} = 0,05 > \dfrac{n_{HCl}}{6} = \dfrac{27}{730} \to Al\ dư\\ n_{Al\ pư} = \dfrac{1}{3}n_{HCl} = \dfrac{27}{365}(mol)\\ \)
\(m_{Al\ dư} = 2,7 - \dfrac{27}{265}.27 = 0,703(gam)\)
Đúng 1
Bình luận (0)
cho 11,7g một kim loại hóa trị II tác dụng vơi 300ml đ HCl 1M, sau pư xong thấy kim loại vẫn còn dư. Cũng lượng kim loại này nếu cho tác dụng với 200ml dd HCl 2M, sau pư xong thấy axit vẫn còn dư. Kim loại đã dùng là ?
nHCl(1) = 0.35 molnHCl(2) = 0.4 molvì kim loại có hóa trị II => nHCl(1)/2 < nKL < nHCl(2)/2 => 0.175 < nKL < 0.2 (mol)=> 58.5 < MKL < 66.86 (g)Vì kim loại tác dụng được với HCl ở điều kiện thường => KL là Zn
Đúng 2
Bình luận (0)
Cho kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a. Viết các phương trình hóa học của các phản ứng.
b. Cho cùng một khối lượng các kim loại trên tác dụng hết với axit dư thì kim loại nào cho nhiều khí hidro nhất?
c. Nếu thu được cùng một thể tích khí hidro thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất?
a)
$Zn + H_2SO_4 \to ZnSO_4 + H_2(1)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2(2)$
$Fe + H_2SO_4 \to FeSO_4 + H_2(3)$
b)
Coi m Zn = m Al = m Fe = 100(gam)
\(n_{H_2(1)} = n_{Zn} = \dfrac{100}{65}(mol)\\ n_{H_2(2)} = \dfrac{3}{2}n_{Al} = \dfrac{3}{2}.\dfrac{100}{27} = \dfrac{100}{18}(mol)\\ n_{H_2(3)} = n_{Fe} = \dfrac{100}{56}(mol)\\\)
Ta thấy :
\(n_{H_2(1)} < n_{H_2(3)} < n_{H_2(2)}\) nên dùng kim loại Al cho được nhiều khí hidro nhất.
c) Coi $n_{H_2} = 1(mol)$
n Zn = n H2 = 1(mol) => m Zn = 1.65 = 65(gam)
n Al = 3/2 n H2 = 1,5(mol) => m Al = 1,5.27 = 40,5(gam)
n Fe = n H2 = 1(mol) => m Fe = 1.56 = 56(gam)
Vậy cùng một thể tích hidro thì Al có khối lượng nhỏ nhất
Đúng 2
Bình luận (0)
a, PT: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\) (1)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\) (2)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\) (3)
b, Giả sử: mZn = mAl = mFe = a (g)
\(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{Al}=\dfrac{a}{27}\left(mol\right)\\n_{Fe}=\dfrac{a}{56}\left(mol\right)\end{matrix}\right.\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2\left(1\right)}=n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{H_2\left(2\right)}=\dfrac{3}{2}n_{Al}=\dfrac{a}{18}\left(mol\right)\\n_{H_2\left(3\right)}=n_{Fe}=\dfrac{a}{56}\left(mol\right)\end{matrix}\right.\)
⇒ Al cho nhiều khí H2 nhất.
c, Giả sử: nH2 (1) = nH2 (2) = nH2 (3) = b (mol)
Theo PT: \(\left\{{}\begin{matrix}n_{Zn}=n_{H_2\left(1\right)}=b\left(mol\right)\\n_{Al}=\dfrac{2}{3}n_{H_2\left(2\right)}=\dfrac{2}{3}b\left(mol\right)\\n_{Fe}=n_{H_2\left(3\right)}=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Zn}=65b\left(g\right)\\m_{Al}=\dfrac{2}{3}b.27=18b\left(g\right)\\m_{Fe}=56b\left(g\right)\end{matrix}\right.\)
⇒ Khối lượng Al pư là nhỏ nhất.
Đúng 1
Bình luận (0)
Tham Khảo :
a) PTHH:
\(\begin{array}{l} \mathrm{Zn}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{ZnSO}_{4}+\mathrm{H}_{2} \\ \mathrm{Fe}+\mathrm{H}_{2} \mathrm{SO}_{4 \text { loãng }} \rightarrow \mathrm{FeSO}_{4}+\mathrm{H}_{2} \\ 2 \mathrm{Al}+3 \mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{Al}_{2}\left(\mathrm{SO}_{4}\right)_{3}+3 \mathrm{H}_{2} \end{array}\)
b) Giả sử một khối lượng là \(\text{a (g)}\) kim loại kẽm sắt và nhôm cho cùng:
\(\begin{array}{l} \mathrm{Zn}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{ZnSO}_{4}+\mathrm{H}_{2}\\ \mathrm{Fe}+\mathrm{H}_{2} \mathrm{SO}_{4 \text { loãng }} \rightarrow \mathrm{FeSO}_{4}+\mathrm{H}_{2}\\ 2 \mathrm{Al}+3 \mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{Al}_{2}\left(\mathrm{SO}_{4)_{3}}+3 \mathrm{H}_{2}\right.\\ \text { Ta có } \mathrm{n}_{\mathrm{Fe}}=\frac{\mathrm{a}}{56} ; \mathrm{n}_{\mathrm{Zn}}=\frac{\mathrm{a}}{65} ; \mathrm{n}_{\mathrm{Al}}=\frac{\mathrm{a}}{27}\\ \text { Theo } \mathrm{pt} \mathrm{n}_{\mathrm{H}_{2}}(1)=\mathrm{n}_{\mathrm{Zn}}=\frac{\mathrm{a}}{65} \mathrm{~mol}\\ \mathrm{n}_{\mathrm{H}_{2}(2)}=\mathrm{n}_{\mathrm{Fe}}=\frac{\mathrm{a}}{56} \mathrm{~mol} \end{array}\)\(\begin{array}{l} \mathrm{n}_{\mathrm{H}_{2}(3)}=\frac{3}{2} \cdot \mathrm{n}_{\mathrm{A} 1}=\frac{3}{2} \cdot \frac{\mathrm{a}}{27}=\frac{\mathrm{a}}{18} \mathrm{~mol}\\ \text { Như vậy ta nhận thấy } \frac{a}{18}>\frac{a}{56}>\frac{a}{65} \Rightarrow \mathrm{n}_{H_{2}}(3)>\mathrm{n}_{\mathrm{H}_{2}}(2)>\mathrm{n}_{\mathrm{H}_{2}}(1) \end{array}\)
Vậy cho cùng một lượng kim loại tác dụng với axit H2SO4 loãng dư thì nhôm cho nhiều khí hidro hơn, sau đó đến sắt và ít nhất là kẽm
c) Nếu thu được cùng một lượng khí hidro thì khối lượng kim loại ít nhất là nhôm, sau đó đến sắt, cuối cùng là kẽm.
Đúng 1
Bình luận (0)
Bài 1 :Cho hỗn hợp bột 2 kim loại nhôm và đồng tác dụng với axit sunfuric loãng (dư).Sau phản ứng thu đc 2,8 gam chất rắn không tan và 6,72 lít khí (đo ở đktc)
1, viết PTHH
2,Tính hỗn hợp bột kim loại
1)
\(2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\\ 2)\\ n_{Al} = \dfrac{2}{3}n_{H_2} = \dfrac{2}{3}. \dfrac{6,72}{22,4} = 0,2(mol)\\ \Rightarrow m_{kim\ loại} = 0,2.27 + 2,8 = 8,2(gam)\)
Đúng 1
Bình luận (0)
2,3g một kim loại A tác dụng với axit hcl dư. sau phản ứng sinh ra 1,12l h2. hãy cho biết A là kim loại nào
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(2A+2nHCl\rightarrow2ACl_n+nH_2\)
\(\dfrac{0,1}{n}\) 0,05 ( mol )
\(M_A=\dfrac{2,3}{\dfrac{0,1}{n}}=23n\)
`@n=1->A` là Natri ( Na )
`@n=2->` Loại
`@n=3->` Loại
Vậy A Natri ( Na )
Đúng 1
Bình luận (0)
Cho 40,5 gam kim loại R (có hóa trị không đổi) tác dụng với dung dịch axit clohiđric dư thu được 50,4 lít khí (đktc). Kim loại R là
A. Mg
B. Al
C. Zn
D. Fe
Cho 40,5 gam kim loại R (có hóa trị không đổi) tác dụng với dung dịch axit clohiđric dư thì thu được 50,4 lít khí (đktc). Kim loại R là
A. Mg.
B. Al.
C. Zn.
D. Fe.
Đáp án B
2R + 2nHCl → 2RCln + nH2↑
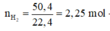
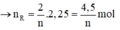
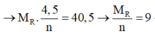
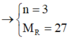
Vậy R là nhôm (Al)
Đúng 0
Bình luận (0)
Cho 40,5 gam kim loại R (có hóa trị không đổi) tác dụng với dung dịch axit clohiđric dư thì thu được 50,4 lít khí (đktc). Kim loại R là A. Mg B. Al C. Zn D. Fe
Đọc tiếp
Cho 40,5 gam kim loại R (có hóa trị không đổi) tác dụng với dung dịch axit clohiđric dư thì thu được 50,4 lít khí (đktc). Kim loại R là
A. Mg
B. Al
C. Zn
D. Fe
Cho 40,5 gam kim loại R (có hóa trị không đổi) tác dụng với dung dịch axit clohiđric dư thì thu được 50,4 lít khí (đktc). Kim loại R là
A. Mg.
B. Al.
C. Zn.
D. Fe.