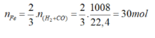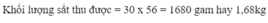cho 6.72l H2 (đktc) khử 32g Fe2O3 ở nhiệt độ cao.Viết PTHH và tính khối lượng sắt tạo ra,
L2
Những câu hỏi liên quan
Khử hoàn toàn 32 gam hỗn hợp CuO; Fe2O3 bằng khí hidro ở nhiệt độ cao.
a. Viết PTHH xảy ra
b. Tính thể tích khí H2 cần để khử hỗn hợp (ở đktc), biết Fe2O3 chiểm 20% khối lượng hỗn hợp.
c.Tính khối lượng các kim loại tạo thành
a)
CuO + H2 --to--> Cu + H2O
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
b) \(n_{Fe_2O_3}=\dfrac{32.20\%}{160}=0,04\left(mol\right)\)
\(n_{CuO}=\dfrac{32-0,04.160}{80}=0,32\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
0,32-->0,32---->0,32
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,04-->0,12-------->0,08
=> VH2 = (0,32 + 0,12).22,4 = 9,856 (l)
c)
mCu = 0,32.64 = 20,48 (g)
mFe = 0,08.56 = 4,48 (g)
Đúng 2
Bình luận (2)
Cho 1,008 m 3 (đktc) hỗn hợp khí Co và H 2 khử hoàn toàn F e 2 O 3 ở nhiệt độ thích hợp. Khối lượng sắt thu được sẽ là (Fe=56)
A. 0,84kg
B. 2,52kg
C. 5,04kg
D. 1,68kg
Bài 1 : Khử hoàn toàn 20g hh A gồm Fe2O3 vá CuO khí H2 ở nhiệt độ cao thu đc hh kim loại và hơi nước . Biết Fe2O3 chiếm 80% khối lượng hh A a, Viết các PTHH b, Tính thể tích H2 ( đktc ) đã dùng c, Tính khối lượng hh B thu đc Bài 2 : Cho hh X gồm CuO và Fe2O3 tác dụng với khí H2 ở nhiệt độ cao thu đc 26,4g hh kim loại Y trong đó khối lượng Cu gấp 1,2 lần khối lượng Fe.a, Tính thể tích H2 ( đktc ) cần dùng .b, Tính khối lượng hh X và thành phần % theo khối lượng các chất trong X Bài 3 : Dùng khí...
Đọc tiếp
Bài 1 : Khử hoàn toàn 20g hh A gồm Fe2O3 vá CuO = khí H2 ở nhiệt độ cao thu đc hh kim loại và hơi nước . Biết Fe2O3 chiếm 80% khối lượng hh A
a, Viết các PTHH
b, Tính thể tích H2 ( đktc ) đã dùng
c, Tính khối lượng hh B thu đc
Bài 2 : Cho hh X gồm CuO và Fe2O3 tác dụng với khí H2 ở nhiệt độ cao thu đc 26,4g hh kim loại Y trong đó khối lượng Cu gấp 1,2 lần khối lượng Fe.
a, Tính thể tích H2 ( đktc ) cần dùng .
b, Tính khối lượng hh X và thành phần % theo khối lượng các chất trong X
Bài 3 : Dùng khí CO để khử hoàn toàn 31,2g hh gồm CuO và Fe3O4 , trong hh này khối lượng Fe3O4 nhiều hơn khối lượng CuO là 15,2g
a, Tính khối lượng các kim loại thu đc
b, Tính thể tích CO đã phản ứng và thể tích CO2 thu đc ( đktc )
Mong các cao nhân giúp em gấp , 2 hôm nữa em phải nộp bài :(
Bài 1:
a) PTHH: \(Fe_2O_3+3H_2\xrightarrow[]{t^o}2Fe+2H_2O\)
\(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
b) Ta có: \(\left\{{}\begin{matrix}m_{Fe_2O_3}=20\cdot80\%=16\left(g\right)\\m_{CuO}=20-16=4\left(g\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\\n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2}=3n_{Fe_2O_3}+n_{CuO}=0,35\left(mol\right)\) \(\Rightarrow V_{H_2}=0,35\cdot22,4=7,84\left(l\right)\)
c) Theo các PTHH: \(\left\{{}\begin{matrix}n_{Fe}=2n_{Fe_2O_3}=0,2\left(mol\right)\\n_{Cu}=n_{CuO}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{hhB}=m_{Fe}+m_{Cu}=0,2\cdot56+0,05\cdot64=14,4\left(g\right)\)
Đúng 3
Bình luận (4)
Bài 2:
PTHH: \(Fe_2O_3+3H_2\xrightarrow[]{t^o}2Fe+3H_2O\)
\(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
a) Vì khối lượng Cu bằng \(\dfrac{6}{5}\) khối lượng Fe
\(\Rightarrow\left\{{}\begin{matrix}m_{Cu}=\dfrac{26,4}{6+5}\cdot6=14,4\left(g\right)\\m_{Fe}=26,4-14,4=12\left(g\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}n_{Cu}=\dfrac{14,4}{64}=0,225\left(mol\right)\\n_{Fe}=\dfrac{12}{56}=\dfrac{3}{14}\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2}=\dfrac{3}{2}n_{Fe}+n_{Cu}=\dfrac{9}{28}+0,225=\dfrac{153}{280}\left(mol\right)\) \(\Rightarrow V_{H_2}=\dfrac{153}{280}\cdot22,4=12,24\left(l\right)\)
b) Theo các PTHH: \(\left\{{}\begin{matrix}n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=\dfrac{3}{28}\left(mol\right)\\n_{CuO}=n_{Cu}=0,225\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe_2O_3}=\dfrac{3}{28}\cdot160\approx17,14\left(g\right)\\m_{CuO}=0,225\cdot80=18\left(g\right)\end{matrix}\right.\) \(\Rightarrow m_{hh}=35,14\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe_2O_3}=\dfrac{17,14}{35,14}\cdot100\%\approx48,78\%\\\%m_{CuO}=51,22\%\end{matrix}\right.\)
Đúng 2
Bình luận (2)
Bài 3:
PTHH: \(CuO+CO\xrightarrow[]{t^o}Cu+CO_2\uparrow\)
\(Fe_3O_4+4CO\xrightarrow[]{t^o}3Fe+4CO_2\uparrow\)
a) Ta có: \(\left\{{}\begin{matrix}m_{Fe_3O_4}=\dfrac{31,2+15,2}{2}=23,2\left(g\right)\\m_{CuO}=31,2-23,2=8\left(g\right)\end{matrix}\right.\)
\(\Rightarrow n_{Fe_3O_4}=\dfrac{23,2}{232}=0,1\left(mol\right)=\dfrac{8}{80}=n_{CuO}\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,3\left(mol\right)\\n_{Cu}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,3\cdot56=16,8\left(g\right)\\m_{Cu}=0,1\cdot64=6,4\left(g\right)\end{matrix}\right.\)
b) Theo các PTHH: \(n_{CO}=n_{CO_2}=n_{Cu}+\dfrac{4}{3}n_{Fe}=\dfrac{7}{30}\left(mol\right)\)
\(\Rightarrow V_{CO}=V_{CO_2}=\dfrac{7}{30}\cdot22,4\approx5,23\left(l\right)\)
Đúng 2
Bình luận (0)
Ở nhiet đo cao khí hiđrô cũng khu dc sắt (III) ôxyt (Fe2O3) tạo ra sắt (Fe) và nước (H2O) a)nếu dùng 6,72 lít khí H2 (đktc) ta sẽ khử đc bao nhiêu gam Fe2o3 b)tính khối lượng Fe sinh ra trong phan ung cho biết Fe=56 Ở=16
nH2 = 6.72/22.4 = 0.3 (mol)
Fe2O3 + 3H2 -to-> 2Fe + 3H2O
0.1_____0.3______0.2
mFe2O3 = 0.1*160 = 16 (g)
mFe = 0.2*56 = 11.2 (g)
Đúng 1
Bình luận (0)
Bài 1 : khử 80g Fe2O3 bằng khí H2 a.Viết PTHH b.Tính thể tích khí H2 ở (đktc) cần dùng và khối lượng chất sắt thu được Bài 2 : cho 5,6g Fe tác dụng vừa đủ với dd HCl a.Viết PTHH b.tính khối lượng HCl đã phản ứng và thể tích khí H2 thu được ở (đktc)
Bài 1 :
\(a) Fe_2O_3 + 3H_2 \xrightarrow{t^o}2Fe + 3H_2O\\ b) n_{Fe_2O_3} = \dfrac{80}{160}= 0,5(mol)\\ n_{H_2} = 3n_{Fe_2O_3} = 1,5(mol)\\ \Rightarrow V_{H_2} = 1,5.22,4 = 33,6(lít)\\ n_{Fe} = 2n_{Fe_2O_3} = 1(mol)\\ m_{Fe} = 1.56 = 56(gam)\)
Bài 2 :
\(a) Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = n_{Fe} =\dfrac{5,6}{56} = 0,1(mol)\\ V_{H_2} = 0,1.22,4 = 2,24(lít)\\ n_{HCl} =2 n_{Fe} = 0,2(mol)\\ m_{HCl} = 0,2.36,5 = 7,3(gam)\)
Đúng 1
Bình luận (0)
Câu 2. Cho 26 g kẽm phản ứng vừa đủ với dung dịch axit clohiđric (HCl). a. Viết PTHH và tính thể tích khí hiđro sinh ra sau phản ứng (ở đktc)? b. Dùng lượng H2 sinh ra ở trên khử 16g sắt (III) oxit (Fe2O3). Tính khối lượng Fe thu được sau khi phản ứng kết thúc?( Zn = 65 ,Fe =56,H =1 ,Cl =35,5 O =16)
a) \(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,4--------------------->0,4
=> VH2 = 0,4.22,4 = 8,96 (l)
b)
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,4}{3}\) => Fe2O3 hết, H2 dư
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,1---------------->0,2
=> mFe = 0,2.56 = 11,2 (g)
Đúng 2
Bình luận (1)
a, nZn = 26/65 = 0,4 (mol)
PTHH: Zn + 2HCl -> ZnCl2 + H2
nZn = nH2 = 0,4 (mol)
VH2 = 0,4 . 22,4 = 8,96 (l)
b, nFe2O3 = 16/160 = 0,1 (mol)
PTHH: Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
LTL: 0,1 < 0,4/3 => H2 dư
nFe = 0,1 . 3 = 0,3 (mol)
mFe = 0,3 . 56 = 16,8 (g)
Khử hoàn toàn 24 gam Fe2O3 bằng khí H2(nung nóng),thu được sắt kim loại và nước. a. Viết PTHH xảy ra b. Tính thể tích khí H2(ở đktc) thu được c. Tính thể tích dd HCl 1.5M cần dùng để hòa tan hết lượng sắt tạo thành từ phản ứng trên.
a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe_2O_3}=\dfrac{24}{160}=0,15\left(mol\right)\)
Theo PT: \(n_{H_2}=3n_{Fe_2O_3}=0,45\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,45.22,4=10,08\left(l\right)\)
c, n\(n_{Fe}=2n_{Fe_2O_3}=0,3\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{HCl}=2n_{Fe}=0,6\left(mol\right)\Rightarrow V_{HCl}=\dfrac{0,6}{1,5}=0,4\left(M\right)\)
Đúng 2
Bình luận (0)
a. Phương trình hoá học của phản ứng khử Fe2O3 bằng H2 là: Fe2O3 + 3H2 -> 2Fe + 3H2O
b. Theo phương trình trên, ta thấy 1 mol Fe2O3 cần 3 mol H2 để khử hoàn toàn. Do đó, số mol H2 cần dùng để khử hoàn toàn 24 gam Fe2O3 là:
n(H2) = 24/(2*55.85) * 3 = 2.56 (mol)
Theo định luật Avogadro, 1 mol khí ở đktc có thể chiếm thể tích là 22.4 lít. Vậy, thể tích khí H2 ở đktc thu được là:
V(H2)= n(H2) * 22.4 = 2.56 * 22.4 = 57.2 (lít)
Vậy thể tích khí H2 thu được là 57.2 lít.
c. Theo phương trình trên, ta thấy 1 mol Fe tạo thành cần 6 mol HCI để hòa tan hoàn toàn. Do đó, số mol HCI cần dùng để hòa tan hết lượng sắt tạo thành là: n(HCI) = 2 * n(H2) * 6 = 30.72 (mol)
Thể tích HCI 1.5M cần dùng là: V(HCI)= n(HCI) C(HCI)= 30.72/1.5 = 20.48 (lít)
Vậy thể tích dd HCI 1.5M cần dùng để hòa tan hết lượng sắt tạo thành là 20.48 lít.
Đúng 0
Bình luận (0)
dùng h2 để khử 32g sắt ba oxit
a,viết pthh
b,tính khối lượng sắt tạo thành
c,tính thể tích khối hidro tham gia phản ứng (đktc)
\(a.PTHH:3H_2+Fe_2O_3\rightarrow\left(t^o\right)2Fe+3H_2O\\b.n_{Fe_2O_3}=\dfrac{32}{160}=0,2\left(mol\right)\\ n_{Fe}=0,2.2=0,4\left(mol\right)\\ n_{H_2}=3.0,2=0,6\left(mol\right)\\ n_{Fe}=0,4.56=22,4\left(g\right)\\ c,V_{H_2\left(đktc\right)}=0,6.22,4=13,44\left(l\right) \)
Đúng 2
Bình luận (0)
a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe_2O_3}=\dfrac{32}{160}=0,2\left(mol\right)\)
Theo PT: \(n_{Fe}=2n_{Fe_2O_3}=0,4\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,4.56=22,4\left(g\right)\)
c, Theo PT: \(n_{H_2}=3n_{Fe_2O_3}=0,6\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,6.22,4=13,44\left(l\right)\)
Đúng 2
Bình luận (1)
Tóm tắt
\(m_{Fe_2O_3}=32g\)
==============
a) viết PTHH
b)\(m_{Fe}=?\left(g\right)\)
c)\(V_{H_2}=?\left(l\right)\)
Giải:
a)PTHH: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
1 : 3 : 2 : 3 (mol)
0,2 -> 0,6 : 0,4 : 0,3 (mol)
b)số mol của 32 g sắt(III) oxit:
\(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{32}{160}=0,2\left(mol\right)\)
Khối lượng của 0,4 mol Fe:
\(m_{Fe}=n.M=0,4.56=22,4\left(g\right)\)
c, Thể tích của 0,6 mol H2:
\(V_{H_2}=n.22,4=0,6.22,4=13,44\left(l\right)\)
Đúng 0
Bình luận (0)
cho hơi nước đi qua than nóng đỏ thu được hỗn hợp hí CO và H2 ( khi thn ướt )
a) Tính thể tích hỗn hợp khí (đktc) thu được từ 1 tấn than chưa 92% cacbon, biết hiệu suất của phản ứng đạt 85%
b)Dùng hỗn hợp khí thu được ở trên để khử Fe2O3 ở nhiệt độ cao.Viết PTHH của phản ứng và tính khối lượng sắt thu được.
P/s:M.n giúp dùm mình, chiều 20/7 mk cần gấp :(((
Trên mạng có đó bạn ( Trên Yahoo đó )
Đúng 0
Bình luận (0)
Khối lượng C = 92%* 1000 = 920 kg => số kmol C = 76,67 kmol
Gọi x và y là số kmol C đã p/ư => x+y = 85%* 76,67= 65,167 kmol
C + H2O--------> CO +H2
x----------------------x------x kmol
C + 2H2O--------> CO2 + 2H2
y------------------------y-------2y kmol
CO2 không khử Fe2O3
3 CO + Fe2O3 -----> 2Fe + 3 CO2
--x-------------------------2x/3 kmol
3H2 + Fe2O3--------> 2Fe + 3H2O
x+2y--------------------->2(x+2y)/3
Số kmol Fe thu được = 2x/3 +2x/3 + 4y/3 = 4(x+y)/3 = (4*65,16)/3 = 86,89 kmol
khối lượng Fe thu được = 86,89*56 =4865,8 kg
Đúng 1
Bình luận (3)