oxi hoá hoàn toàn m gam kim loại M thu được 1.25m gam oxit. Xác định M
BN
Những câu hỏi liên quan
đốt cháy hoàn toàn 10,8 gam kim loại (III) trong bình chứa khí oxi thu được 20,4 gam oxit xác định kim loại và tên oxit thu được
áp dụng ĐLBTKL:
mR + mO2 = mR2O3
=> mO2=20,4-10,8=9,6(g)
=> nO2=9,6/32=0,3(mol)
4R + 3O2 ---to---> 2R2O3
0,4........0,3
MR=10,8/0,4=27(g)
=> R là nhôm ......Al
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn 10,2 g một oxit kim loại hoá trị III trong HCl dư, sau phản ứng thu được 26,7 g muối. Xác định công thức của oxit kim loại trên
M2O3+6HCl->2MCl3+3H2O
Ta có:nM2O3=\(\dfrac{10,2}{2M+48}\)
nMCl3=\(\dfrac{26,7}{M+106,5}\)
Theo pthh:\(\dfrac{10,2}{2M+48}\)*2=\(\dfrac{26,7}{M+106,5}\)
=>M=27
Vậy CT của oxit kim loại trên là Al2O3
Đúng 1
Bình luận (1)
Cho 7,2g một kim loại hoá trị II phản ứng hoàn toàn với dung dịch HCl , thu được 0,3 mol H2 ở đktc . Xác định tên kim loại đã dùng
Gọi kim loại hóa trị II đó là A
PTHH: \(A+2HCl\rightarrow ACl_2+H_2\)
Theo đề bài ta có: \(n_{H_2}=0,3\left(mol\right)\)
Theo PT \(\Rightarrow n_A=n_{H_2}=0,3\left(mol\right)\)
\(\Rightarrow M_A=\dfrac{m}{n}=\dfrac{7,2}{0,3}=24\left(g/mol\right)\)
Vậy tên kim loại là Magie (Mg)
Đúng 0
Bình luận (0)
Gọi kim loại cần tìm là R
R + 2HCl → RCl2 + H2
Theo PT: \(n_R=n_{H_2}=0,3\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{7,2}{0,3}=24\left(g\right)\)
Vậy R là kim loại magiê Mg
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 1,2 gam kim loại M ( hoá trị n ) trong khí Cl2 dư , thu được 4,75 gam muối clorua.
a, Viết PTHH , xác định kim loại M.
b, Cần lấy bao nhiêu gam KMnO4 tác dụng với dd HCl đặc ,dư để điều chế được lượng Cl2 vừa đủ cho phản ứng trên.
a, Áp dụng ĐLBTKL :
\(m_M+m_{Cl_2}=4,75\rightarrow m_{Cl_2}=4,75-1,2=3,55g\)
\(\rightarrow n_{Cl_2}=\dfrac{3,55}{71}=0,05mol\)
PTHH :
\(2M+nCl_2\underrightarrow{t^0}2RCl_n\)
\(\dfrac{0,1}{n}\).......\(0,05\)
\(m=M.\dfrac{0,1}{n}=1,2\Rightarrow0,1M=1,2n\Rightarrow M=12n\).
Ta có :
- Nếu \(n=1\Rightarrow M=12\left(loại\right)\)
- Nếu \(n=2\Rightarrow M=24\left(Mg\right)\)
- Nếu \(n=3\Rightarrow M=36\left(loại\right)\)
Kim loại cần tìm là Magie ( Mg )
b ) PTHH :
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2\uparrow+8H_2O\)
0,02.........................................................................0,05
\(\rightarrow m_{KMnO_4}=0,02.158=3,16\left(g\right)\)
Đúng 0
Bình luận (3)
a) PTHH: 2M + nCl2 -> 2MCln (1)
Theo ĐLBTKL, ta có:
\(m_M+m_{Cl_2}=m_{MCl_n}\\ =>m_{Cl_2}=m_{MCl_n}-m_M=4,75-1,2=3,55\left(g\right)\\ =>n_{Cl_2}=\dfrac{3,55}{71}=0,05\left(mol\right)\\ =>n_M=\dfrac{2.0,05}{n}=\dfrac{0,1}{n}\left(mol\right)\)
=> \(m_M=\dfrac{0,1M}{n}=1,2=>0,1M=1,2n=>M=12n\)
Lập bảng:
| n | 1 | 2 | 3 |
| M | 12 | 24 | 36 |
| KL | Loại | Nhận (Mg=24) | Loại |
=> Kim loại M là magie (Mg=24)
b) PTHH: 2KMnO4 +16HCl -> 2KCl + 2MnCl2 + 5Cl2 + 8H2O (2)
Ta có: \(n_{Cl_2\left(2\right)}=n_{Cl_2\left(1\right)}=0,05\left(mol\right)\\ =>n_{KMnO_4}=\dfrac{2.0,05}{5}=0,02\left(mol\right)\\ =>m_{KMnO_4}=0,02.158=3,16\left(g\right)\)
Đúng 0
Bình luận (6)
Cho 3,36(l) Oxi (đktc) phản ứng hoàn toàn với 1 kim lọa có hóa trị III thu được 10,2g Oxit. Xác định tên kim loại?
Gọi CTTQ của kim loại hóa trị III là \(R_2O_3\)
PTHH: \(4R+3O_2\underrightarrow{t^o}2R_2O_3\)
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Theo PT ta có: \(n_{R_2O_3}=\dfrac{0,15.2}{3}=0,1\left(mol\right)\)
\(\Rightarrow M_{R_2O_3}=\dfrac{10,2}{0,1}=102\left(g/mol\right)\)
\(M_{R_2O_3}=R.2+O.3\)
\(\Leftrightarrow102=R.2+48\)
\(\Rightarrow R=27\)
Vậy R là kim loại Nhôm (Al) có hóa trị III
Đúng 1
Bình luận (0)
PTHH: M2O3 + 6HCl --> 2MCl3 + 3H2O
Cứ 1 mol M2O3 --> 2 mol MCl3
2M + 48 (g) --> 2M + 213 (g)
10,2 (g) --> 26,7 (g)
=> 53,4M + 1281,6 = 20,4M + 2172,6
=> 33M = 891
=> M = 27 (Al)
=> CTHH của oxit là Al2O3
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn oxit kim loại hóa trị 2 vào một lượng vừa đủ H2SO4 A% thu được dung dịch muối B%
a, Xác định nguyên tử khối theo A và B
b, Cho A = 10% ; B= 11,6% . Xác định oxit kim loại
b)
AO + H2SO4 ---> ASO4 + H2O
1mol..1mol..........1mol
theo bảo toàn khối lượng ta có
m dd = m AO + m H2SO4
= 16 + A + 98.100/10= 996 + A(g)
m ASO4 = 96 + A
=> pt
(96 + A)/(996 + A)= 11,77%
=> A = 24 ( Mg)
=> MgO
Tham khảo
Đúng 0
Bình luận (0)
Cho 7,2 g một kim loại M chưa rõ hoá trị, phản ứng hoàn toàn với 21,9 g HCL. Xác định tên kim loại đã dùng.
Giả sử kim loại đó là A
Gọi số mol kim loại A là x
nHCl=m/M=21,9/36,5=0,6 (mol)
Ta có PT:
2A + 2xHCl -> 2AClx +xH2
2..........2x..............2..............x (mol)
0,6x <- 0,6 -> 0,6x (mol)
Theo đề : mA=7,2 g
<=> nA.MA=7,2
<=> 0,6x.MA=7,2
<=> MA=12.x
Lập bảng:
| MA | 12 | 24 | 36 |
| \(x\) | 1(loại) | 2 (nhận) | 3 (loại) |
Vậy Kim loại đó là :Mg(II)
Đúng 0
Bình luận (0)
Gọi hóa trị kim loại đó là x ( 0<x<4)
PTHH : 2M + 2xHCl -> 2MClx + xH2
nHCl= 21,9/36,5=0,6 (mol)
Theo PTHH , nM = \(\dfrac{1}{x}n_{HCl}\)=\(\dfrac{0,6}{x}\)(mol)
Ta có : MM . nM = 7,2
=> Ta có các trường hợp sau :
+ x=1 => MM= 12 => loại
+ x=2 => MM = 24 => kim loại đó là Mg
+ x=3 => MM = 36 => loại
Vậy kim loại đã dùng là Mg
Đúng 0
Bình luận (0)
Bài 1.Đốt cháy hết 2.4 gam một kim loại R thì thu được 4 g oxit. Xác định R và CTHH
Bài 2.Đốt cháy hoàn toàn 7.84 lit CO và H2 (đktc) sau p/ư thu được 10.2 gam hỗn hợp CO2 và H2O. Tính %V của mỗi chất trong hỗn hợp ban đầu.
Bài 1.
Gọi n là hóa trị của kim loại R chưa rõ hóa trị
\(4R\left(\dfrac{8}{2R+16n}\right)+nO_2-t^o->2R_2O_n\left(\dfrac{4}{2R+16n}\right)\)
\(n_{R_2O_n}=\dfrac{4}{2R+16n}\left(mol\right)\)
Theo PTHH, ta có: \(n_R=\dfrac{8}{2R+16n}\left(mol\right)\)
\(n_R=\dfrac{2,4}{R}\left(mol\right)\)
\(\Rightarrow\dfrac{2,4}{R}=\dfrac{8}{2R+16n}\)
\(\Leftrightarrow8R=4,8R+38,4n\)
\(\Rightarrow R=12n\)
| \(n\) | \(1\) | \(2\) | \(3\) |
| \(R\) | \(12(loại)\) | \(24(Mg)\) | \(36(loại)\) |
R là Magie. CTHH của oxit: MgO
Đúng 0
Bình luận (0)
Bài 1 : CTHH dạng TQ của oxi kim loại R là RxOy
PTHH :
2xR + yO2 \(\underrightarrow{t^o}\) 2RxOy
Theo ĐLBTKL:
mR + mO2 = mRxOy
\(\Rightarrow\) 2,4 + mO2 = 4 \(\Rightarrow\) mO2 = 4 -2,4 = 1,6(g)
=> nO2 = 1,6/32 = 0,05(mol)
Theo PT : nR = 2x/y . nO2 = 2x/y . 0,05 = 0,1x/y (mol)
=> MR = m/n = 2,4 : 0,1x/y = 24y/x
Biện luận thay x , y =1,2,3.... thấy chỉ có x=y=1 thỏa mãn
=> MR = 24 (g)
=> R là kim loại Magie (Mg)
Đúng 0
Bình luận (0)
bài 2
\(2CO\left(a\right)+O_2-t^o->2CO_2\left(a\right)\)
\(2H_2\left(b\right)+O_2-t^o->2H_2O\left(b\right)\)
\(n_{\left(CO+H_2\right)}=\dfrac{7,84}{22,4}=0,35mol\)
Ta có HPT :
\(\left\{{}\begin{matrix}a+b=0,35\\44a+18b=10,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,15\\b=0,2\end{matrix}\right.\)
Vì là chất khí nên %V = %n
=> \(\%V_{CO}=\dfrac{0,15}{0,15+0,2}.100\%=42,857\%\)
=> \(\%V_{H_2}=\dfrac{0,2}{0,2+0,15}.100\%=57,143\%\)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Khử hoàn toàn m gam oxit MxOy cần vừa đủ 17,92 lít khí CO (đktc), thu được a gam kim loại M. Hòa tan hết a gam M bằng dung dịch H2SO4 đặc nóng (dư), thu được 20,16 (lít) khí SO2 (sản phẩm khử duy nhất, ở đktc). Oxit MxOy là: A. Cr2O3 B. FeO C. Fe3O4 D. CrO
Đọc tiếp
Khử hoàn toàn m gam oxit MxOy cần vừa đủ 17,92 lít khí CO (đktc), thu được a gam kim loại M. Hòa tan hết a gam M bằng dung dịch H2SO4 đặc nóng (dư), thu được 20,16 (lít) khí SO2 (sản phẩm khử duy nhất, ở đktc). Oxit MxOy là:
A. Cr2O3
B. FeO
C. Fe3O4
D. CrO
Đáp án C
Ta có: nCO = 0,8 mol; = 0,9 mol
Gọi n là hóa trị của kim loại M (1 ≤ n ≤ 3)
Trong phản ứng giữa M với H2SO4 đặc nóng, M là chất khử nhường electron.
H2SO4 đặc là chất oxi hóa nhận electron:

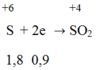
Trong phản ứng khử oxit kim loại bởi CO ta luôn có:
nO (trong oxit) = nCO = 0,8 mol
⇒Tỉ lệ:
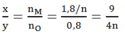
Dựa vào các đáp án ta thấy n = 2 hoặc n = 3

Đúng 0
Bình luận (0)








