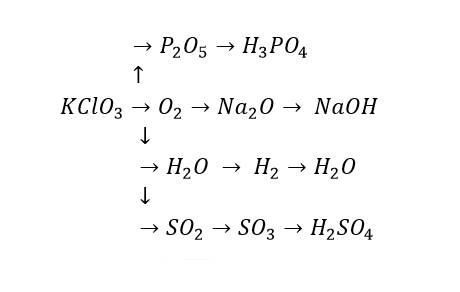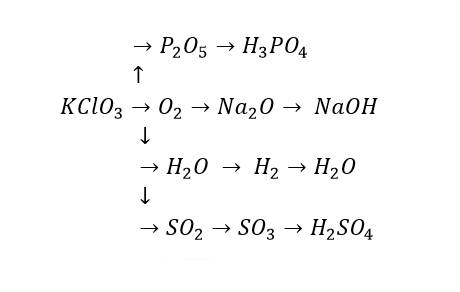%Oxi có trong nước là bao nhiêu ? A. 11.1%. B. 88.9%. C. 90%. D. 10%
Bài 24: Tính chất của oxi
%Oxi có trong nước là bao nhiêu ? A. 11.1%. B. 88.9%. C. 90%. D. 10%
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Đốt cháy hoàn toàn m gam photpho trong o2 lấy dư thu được 7,1g photpho (V) oxit
a.Viết phương trình phản ứng xảy ra
b.Nếu sau phản ứng O2 còn dư 15% so với lượng phản ứng thì thể tích O2 đem dùng là bao nhiêu l ?
Giúp mk vs ạ ![]()
a. 4P + 5O2 -> (nhiệt độ) 2P2O5.
b. nP2O5 = 7,1/142 = 0,05 mol
=> nO2 pư = 0,125 mol
=> VO2 thực tế = 0,125 x 1,15 x 22,4 = 3,22 L
Đúng 0
Bình luận (0)
1. Đốt cháy hoàn toàn 4,8 g Mg trong bình chứa V(l) O2 (vừa đủ đktc). Tính V.
2. Đốt cháy hoàn toàn m(g) P trong bình chứa khí O2 thu được 28,2 g P2O5. Tính m = ?
mong mn giúp ạ.
1. \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
\(2Mg+O_2\xrightarrow[]{t^\circ}2MgO\)
0,2 → 0,1
\(\Rightarrow V_{O_2}=0,1\cdot22,4=2,24\left(l\right)\)
2. \(n_{P_2O_5}=\dfrac{28,2}{142}=\dfrac{141}{710}\left(mol\right)\)
\(4P+5O_2\xrightarrow[]{t^\circ}2P_2O_5\)
\(\dfrac{141}{355}\) ← \(\dfrac{141}{710}\)
\(\Rightarrow m_P=\dfrac{141}{355}\cdot31\approx12,312\left(g\right)\)
Đúng 3
Bình luận (1)
1, \(2Mg+O_2--->2MgO\)
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
Theo pt \(n_{O_2}=\dfrac{n_{Mg}}{2}=\dfrac{0,2}{2}=0,1\left(mol\right)\)
\(V_{O_2}=n\times22,4=0,1\times22,4=2,24\left(lít\right)\)
2, \(4P+5O_2-->2P_2O_5\)
\(n_{P_2O_5}=\dfrac{28,2}{2\times31+5\times16}\approx0,2\left(mol\right)\)
Theo phương trình :
\(n_P=\dfrac{n_{P_2O_5}}{2}=\dfrac{0,2}{2}=0,1\left(mol\right)\)
\(m_P=0,1\times31=3,1\left(g\right)\)
Đúng 0
Bình luận (1)
Bài 1:
PT: \(4Na+O_2\underrightarrow{t^o}2Na_2O\)
\(Ca+\dfrac{1}{2}O_2\underrightarrow{t^o}CaO\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(S+O_2\underrightarrow{t^o}SO_2\)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
\(C+O_2\underrightarrow{t^o}CO_2\)
\(C_2H_6+\dfrac{7}{2}O_2\underrightarrow{t^o}2CO_2+3H_2O\)
\(C_6H_6+\dfrac{15}{2}O_2\underrightarrow{t^o}6CO_2+3H_2O\)
Bài 2:
Ta có: \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
PT: \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
Theo PT: \(n_{P_2O_5}=\dfrac{1}{2}n_P=0,1\left(mol\right)\) \(\Rightarrow m_{P_2O_5}=0,1.142=14,2\left(g\right)\)
Bài 3:
Ta có: \(n_{C_2H_2}=\dfrac{2,6}{26}=0,1\left(mol\right)\)
PT: \(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
Theo PT: \(n_{O_2}=\dfrac{5}{2}n_{C_2H_2}=0,25\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,25.24,79=6,1975\left(l\right)\)
Đúng 2
Bình luận (0)
Đốt cháy 5,6 l khí metan (CH4) cần V lít khí oxi a) viết phương trình phản ứng hoá học b) tính thể tích khí oxi(điều kiện tiêu chuẩn) và khối lượng nước sinh ra sau khi ngưng tụ
a)
$CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O$
b) Theo PTHH : $V_{O_2} = 2V_{CH_4} = 11,2(lít)$
$n_{CH_4} = \dfrac{5,6}{22,4} = 0,25(mol)$
Theo PTHH : $n_{H_2O} = 2n_{CH_4} = 0,5(mol)$
$m_{H_2O} = 0,5.18 = 9(gam)$
Đúng 1
Bình luận (0)
\(a,CH_4+2O_2\rightarrow CO_2+2H_2O\)
\(1:2:1:2\left(mol\right)\)
\(0,25:0,5:0,25:0,5\left(mol\right)\)
\(n_{CH_4}=\dfrac{V}{22,4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(b,V_{O_2}=n.22,4=0,5.22,4=11,2\left(l\right)\)
\(m_{H_2O}=n.M=0,5.18=9\left(g\right)\)
Đúng 0
Bình luận (0)
PT: \(C+O_2\underrightarrow{t^o}CO_2\)
Ta có: \(n_{O_2}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
a, Theo PT: \(n_C=n_{O_2}=0,025\left(mol\right)\)
\(\Rightarrow m_C=0,025.12=0,3\left(g\right)\)
b, Theo PT: \(n_{CO_2}=n_{O_2}=0,025\left(mol\right)\)
\(\Rightarrow V_{CO_2}=0,025.22,4=0,56\left(l\right)\)
Đúng 0
Bình luận (0)
$2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2$
$4P + 5O_2 \xrightarrow{t^o} 2P_2O_5$
$P_2O_5 + 3H_2O \to 2H_3PO_4$
$4Na + O_2 \xrightarrow{t^o} 2Na_2O$
$Na_2O + H_2O \to 2NaOH$
$2H_2 + O_2 \xrightarrow{t^o} 2H_2O$
$2H_2O \xrightarrow{đp} 2H_2 + O_2$
$S + O_2 \xrightarrow{t^o} SO_2$
$2SO_2 + O_2 \xrightarrow{t^o,xt} 2SO_3$
$SO_3 + H_2O \to H_2SO_4$
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 3,1g photpho (P) trong không khí dư. Tính khối lượng của chất rắn sau phản ứng.
7,1g.
14,2g.
5,5g.
11g.
\(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
0,1-------------->0,05
=> mP2O5 = 0,05.142 = 7,1 (g)
=> A
Đúng 2
Bình luận (2)
4.1/Đốt chảy 12,4 gam photpho P trong bình có 12,8 gam oxi Oz a/ Viết phương trình phản ứng xảy ra b/ Hãy cho biết chất nào còn dư ? Dư bao nhiêu gam ?
nP = 12,4 :31 = 0,4 (mol)
nO2 = 12,8 : 32= 0,4 (mol)
pthh: 4P + 5O2 -t-> 2P2O5
LTL : \(\dfrac{0,4}{4}\) < \(\dfrac{0,4}{5}\)
=> P dư
theo pthh , nP(pư)= \(\dfrac{4}{5}\)nO2 = 0,32 (mol)
=> nP(d) = nO2(bđ) - nO2(pư ) = 0,4 - 0,32 = 0,08 (mol)
=> mP(d) = 0,08 . 31 = 2,48 (G)
Đúng 1
Bình luận (0)