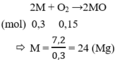đốt cháy hoàn toàn 19,2g kim loại X có hóa trị 2 cần dùng hết 8,96l oxi ở đktc
NT
Những câu hỏi liên quan
Đốt cháy hoàn toàn 22,4 g kim loại X có hóa trị II cần dùng hết 4,48 lít khí oxi ở đktc. Xác định tên kim loại X
Số mol của khí oxi ở dktc
nO2 = \(\dfrac{V_{O2}}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : 2X + O2 → 2XO\(|\)
2 1 2
0,4 0,2
Số mol của kim loại X
nX = \(\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
⇒ MX = \(\dfrac{m_X}{n_X}=\dfrac{22,4}{0,4}=56\) (dvc)
Vậy kim loại x là Fe
Chúc bạn học tốt
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 7,2 gam một kim loại có hóa trị II cần dùng hết 3,36 lít oxi (đktc). Kim loại đó là
A. Zn
B. Cu
C. Fe
D. Mg
đốt cháy hoàn toàn 13g kim loại ko biết hóa trị cần dùng 2,24 l khí Oxi ở đktc
cho biết tên kim loại đó
PTHH: \(4R+xO_2\xrightarrow[]{t^o}2R_2O_x\) (x là hóa trị của kim loại R)
Ta có: \(n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(\Rightarrow n_R=\dfrac{0,4}{x}\left(mol\right)\) \(\Rightarrow M_R=\dfrac{13}{\dfrac{0,4}{x}}=\dfrac{65x}{2}\)
Ta thấy với \(x=2\) thì \(M_R=65\)
Vậy kim loại cần tìm là Kẽm (Zn)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 9,3 g một phi kim X có hóa trị V cần dùng hết 8,4 lít khí Oxi
( đktc) thu được một Oxit. Xác định phi kim X.
nO2 = 8,4/22,4 = 0,375 (mol)
PTHH: 4X + 5O2 -> (t°) 2X2O5
Mol: 0,3 <--- 0,375
M(X) = 9,3/0,3 = 31 (g/mol)
=> X là P
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 8,1 gam của một kim loại A hóa trị III cần dùng hết 5,04 lít khí Oxi ( đktc) ở nhiệt độ cao thu được một Oxit. Kim loại A là
A. Fe B. Al C. Cr D. Kết quả khác.
Đốt cháy hoàn toàn 8,1 gam của một kim loại A hóa trị III cần dùng hết 5,04 lít khí Oxi ( đktc) ở nhiệt độ cao thu được một Oxit. Kim loại A là
A. Fe B. Al C. Cr D. Kết quả khác.
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
Đốt cháy hoàn toàn 1,08 gam bột nhôm.
a. Tính thể tích khí oxi cần dùng (đktc).
b. Lượng khí oxi đã phản ứng ở trên vừa đủ tác dụng với 3,84 gam một kim loại A có hóa trị II. Xác định kim loại A.
4Al+3O2-to>2Al2O3
0,04---0,03------0,02 mol
n Al=\(\dfrac{1,08}{27}\)=0,04 mol
=>VO2=0,03.22,4=0,672l
b)
2A+O2-to>2AO
0,06--0,03 mol
=>\(\dfrac{3,84}{A}=0,06\)
=>A=64 :=>Al là Đồng
Đúng 2
Bình luận (2)
đốt cháy hoàn toàn 4,8 gam kim loại A có hóa trị II cần 4,48 lít khí oxi (ở đktc). A là kim loại nào sau đây?
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(2A+O_2\rightarrow\left(t^o\right)2AO\)
0,4 0,2 ( mol )
\(M_A=\dfrac{4,8}{0,4}=12\) ( g/mol )
--> A là Cabon ( C )
Đúng 7
Bình luận (1)
Đốt cháy hoàn toàn 1,08 gam kim loại M ( hóa trị không đổi) cần dùng hết 0,672 lit khí O2(đktc). Tìm kim loại M.
\(n_{O_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
PTHH: 4M + nO2 --to--> 2M2On
\(\dfrac{0,12}{n}\leftarrow0,03\)
\(\Rightarrow M_M=\dfrac{1,08}{\dfrac{0,12}{n}}=9n\left(\dfrac{g}{mol}\right)\)
Xét n = 3 tm => MM = 27 (g/mol)
=> M là Al
Đúng 2
Bình luận (0)
đốt cháy hoàn toàn một kim loại A có hóa trị II cần vừa đủ 2.24 lít khí oxi ở đktc. Sau phản ứng thu được 6.72g Oxit. xác định kim loại A
\(n_{O_2} = \dfrac{2,24}{22,4} = 0,1(mol)\\ 2A + O_2 \xrightarrow{t^o} 2AO\\ n_{Oxit} = 2n_{O_2} = 0,2(mol)\\ \Rightarrow M_{Oxit}= A + 16 = \dfrac{6,72}{0,2}=\dfrac{168}{5}\\ \Rightarrow A = 17,6\)
(Sai đề)
Đúng 0
Bình luận (0)