Bài 1. Cho 11,2 g Fe tác dụng vừa đủ với HCl. Sau phản ứng thu được FeCl2 và V lít khí hydrogen ở đkc. a. Tìm V? b. Tìm khối lượng của FeCl2 tạo ra sau phản ứng. c. Tìm khối lượng của HCl đã dùng.
pthh: \(Fe+2HCl--->FeCl_2+H_2\uparrow\)
a. \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(\Rightarrow n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,2.24,79=4,958\left(l\right)\)
b. \(n_{FeCl_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{FeCl_2}=0,2.127=25,4\left(g\right)\)
c. \(n_{HCl}=2.0,2=0,4\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\)
Đúng 1
Bình luận (0)
`n_(Fe)=m/M=11,2/56=0,2(`mol`)`
PTHH: Fe + 2HCl `->` FeCl2 + H2
mol : 1 2 1 1
mol : 0,2 0,4 0,2 0,2
`V_(H_2)=n.24,79=0,2.24,79=4,958(`L`)`
`m_(FeCl_2)=n.M=0,2.127=25,4(`m`)`
`m_(HCl)=n.M=0,4.36.5=14,6`(g`)`
Đúng 0
Bình luận (0)
(Mệnh đề nào đúng, mệnh đề nào sai)Câu 5: Nylon-6,6 một loại polymer tổng hợp, được sử dụng phổ biến trong các ngành công nghiệp khác nhau, bởi các đặc tính đặc biệt và phạm vi ứng dụng rộng rãi của nó. Nó được xem là một trong những loại nhựa kỹ thuật được sử dụng phổ biến nhất. Nylon-6,6 là một polymer được tổng hợp từ adipic acid và và hexamethylenediamine.a. Nylon-6,6 được tổng hợp bằng phương pháp trùng ngưng.b. Trong một mắt xích của nylon-6,6, nguyên tố carbon chiếm 31,86% về khối lượng.c...
Đọc tiếp
(Mệnh đề nào đúng, mệnh đề nào sai)
Câu 5: Nylon-6,6 một loại polymer tổng hợp, được sử dụng phổ biến trong các ngành công nghiệp khác nhau, bởi các đặc tính đặc biệt và phạm vi ứng dụng rộng rãi của nó. Nó được xem là một trong những loại nhựa kỹ thuật được sử dụng phổ biến nhất. Nylon-6,6 là một polymer được tổng hợp từ adipic acid và và hexamethylenediamine.
a. Nylon-6,6 được tổng hợp bằng phương pháp trùng ngưng.
b. Trong một mắt xích của nylon-6,6, nguyên tố carbon chiếm 31,86% về khối lượng.
c. Nylon-6,6 thuộc loại poliamide bền với nhiệt nhưng kém bền trong môi trường acid hoặc base.
d. Vải nylon-6,6 có thể giặt chung với xà phòng có độ kiềm cao.
Câu 5: Nylon-6,6 một loại polymer tổng hợp, được sử dụng phổ biến trong các ngành công nghiệp khác nhau, bởi các đặc tính đặc biệt và phạm vi ứng dụng rộng rãi của nó. Nó được xem là một trong những loại nhựa kỹ thuật được sử dụng phổ biến nhất. Nylon-6,6 là một polymer được tổng hợp từ adipic acid và và hexamethylenediamine.
a. Nylon-6,6 được tổng hợp bằng phương pháp trùng ngưng. (Đúng)
b. Trong một mắt xích của nylon-6,6, nguyên tố carbon chiếm 31,86% về khối lượng.
(Sai)=>`(C_12H_22N_2O_2)_n=>%_(mC)=63,72%`
c. Nylon-6,6 thuộc loại poliamide bền với nhiệt nhưng kém bền trong môi trường acid hoặc base. (Đúng)
d. Vải nylon-6,6 có thể giặt chung với xà phòng có độ kiềm cao. (Sai)
Đúng 2
Bình luận (0)
Cho 7 dung dịch đựng riêng biệt trong 7 lọ bị mất nhãn sau: AgNO3, Fe(NO3)2, AlCl3, NaHCO3, BaCl2, Na2CO3 và NaHSO4. Chỉ dùng thêm dung dịch HCl loãng làm thuốc thử, trình bày cách nhận biết các dung dịch trên. Viết phương trình hóa học của các phản ứng xảy ra.
- Trích mẫu thử.
- Nhỏ từ từ HCl đến dư vào từng mẫu thử.
+ Có tủa trắng: AgNO3
PT: \(AgNO_3+HCl\rightarrow HNO_3+AgCl\)
+ Có khí thoát ra ngay: NaHCO3.
PT: \(NaHCO_3+HCl\rightarrow NaCl+CO_2+H_2O\)
+ Một lúc sau thấy có khí thoát ra: Na2CO3.
PT: \(Na_2CO_3+HCl\rightarrow NaHCO_3+NaCl\)
\(NaHCO_3+HCl\rightarrow NaCl+CO_2+H_2O\)
+ Không hiện tượng: Fe(NO3)2, AlCl3, BaCl2, NaHSO4 (1)
- Cho mẫu thử nhóm (1) pư với Na2CO3 vừa nhận biết được.
+ Có tủa trắng: Fe(NO3)2, BaCl2. (2)
PT: \(Na_2CO_3+Fe\left(NO_3\right)_2\rightarrow2NaNO_3+FeCO_3\)
\(BaCl_2+Na_2CO_3\rightarrow BaCO_3+2NaCl\)
+ Có hiện tượng sủi bọt khí: NaHSO4.
PT: \(Na_2CO_3+2NaHSO_4\rightarrow2Na_2SO_4+CO_2+H_2O\)
+ Vừa có khí thoát ra, vừa có tủa trắng: AlCl3
PT: \(2AlCl_3+3Na_2CO_3+3H_2O\rightarrow2Al\left(OH\right)_3+3CO_2+6NaCl\)
- Cho mẫu thử nhóm (2) pư với NaHSO4 vừa nhận biết được.
+ Có tủa trắng: BaCl2
PT: \(BaCl_2+NaHSO_4\rightarrow BaSO_4+NaCl+HCl\)
+ Không hiện tượng: Fe(NO3)2
- Dán nhãn.
Đúng 2
Bình luận (0)
Mng giúp mình câu này vớiMagnesium (Mg) là một trong những nguyên tố vi lượng đóng vai trò quan trọng của cơ thể, giúp xương chắc khỏe, tim khỏe mạnh và lượng đường trong máu bình thường. Tỉ lệ phần trăm số nguyên tử các đồng vị của magnesium được xác định theo phổ khối lượng như hình dưới đây (biết rằng điện tích z của các ion đồng vị của magnesium đều bằng +2): (a) Tính nguyên tử khối trung bình của magnesium.(b) Tính %(m) của đồng vị 25Mg có trong MgSO4 , cho S32, O16.(c) Tính khối lượng c...
Đọc tiếp
Mng giúp mình câu này với
Magnesium (Mg) là một trong những nguyên tố vi lượng đóng vai trò quan trọng của cơ thể, giúp xương chắc khỏe, tim khỏe mạnh và lượng đường trong máu bình thường. Tỉ lệ phần trăm số nguyên tử các đồng vị của magnesium được xác định theo phổ khối lượng như hình dưới đây (biết rằng điện tích z của các ion đồng vị của magnesium đều bằng +2):
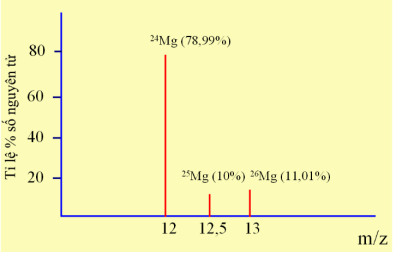
(a) Tính nguyên tử khối trung bình của magnesium.
(b) Tính %(m) của đồng vị 25Mg có trong MgSO4 , cho S=32, O=16.
(c) Tính khối lượng của 25Mg có trong 12,032 gam MgSO4.
a, \(\overline{M}=\dfrac{24.78,99+25.10+26.11,01}{100}=24,3202\left(g/mol\right)\)
b, \(\%^{25}Mg=\dfrac{24,3202.10\%}{24,3202+32+16.4}.100\%=2,02\%\)
c, \(n_{^{25}Mg}=\dfrac{12,032}{24,3202+32+16.4}.10\%.25=0,25\left(g\right)\)
Đúng 2
Bình luận (0)
Cho CuO phản ứng với 125g dung dịch H2SO4 20% . Sau phản ứng thu được CuSO4 và H2O
a)Tính khối lượng CuO
b)Tính khối lượng CuSO4 tạo thành
PLS
a. PTHH: \(Cuo+H_2SO_4\rightarrow CúSO_4+H_2\)
0,255 0,255 0,255 0,255
khối lượng chất tan H2SO4 là:
\(C\%=\dfrac{m_{ct}}{m_{đd}}\cdot100\%\Rightarrow m_{ct}=\dfrac{C\cdot m_{dd}}{100}\)
\(m_{ct}=\dfrac{20\cdot125}{100}=25\left(g\right)\)
số mol H2SO4 là: \(n_{H_2SO_4}=\dfrac{m}{M_{H2SO4}}=\dfrac{25}{98}\approx0,255\left(mol\right)\)
khối lượng của CuO là: \(m_{CuO}=n_{CuO}\cdot M_{CuO}=0,255\cdot80=20,4\left(g\right)\)
b. khối lượng CuSO4 tạo thành là:
\(m_{CuSO_4}=n_{CuSO_4}\cdot M_{CuSO_4}=0,255\cdot160=40,8\left(g\right)\)
Đúng 1
Bình luận (0)
\(4K+O_2\rightarrow2K_2O\\ 4Na+O_2\rightarrow2Na_2O\\ 2Ca+O_2\rightarrow2CaO\\ 4Al+3O_2\rightarrow2Al_2O_3\\ 2Fe+O_2\rightarrow2FeO\\ 2Cu+O_2\rightarrow2CuO\\ 4Ag+O_2\rightarrow2Ag_2O\\ S+O_2\rightarrow SO_2\\ C+O_2\rightarrow CO_2\\ 4P+5O_2\rightarrow2P_2O_5\)
Đúng 2
Bình luận (0)
Xác định công thức phân tử của hợp chất hữu cơ X biết rằng X chứa 85,71 % C; 14,29%H.Biết 1 lít A ở đkc nặng 13gam
Cho 2,7 gam
Amoxicillin là thuốc kháng sinh có thể dùng để điều trị nhiễm khuẩn đường hô hấp trên, đường tiết niệu… Nồng độ tối thiểu có thể kháng khuẩn là 0,04 mg/1kg thể trọng. Khi kê đơn cho một bệnh nhân nặng 50kg, bác sĩ kê đơn mỗi lần uống 1 viên thuốc (có hàm lượng Amoxicilin 500 mg/viên). Bệnh nhân cần uống các viên thuốc tiếp theo cách lần đầu bao nhiêu lâu? Biết rằng chu kì bán hủy của Amoxicilin trong cơ thể người là 61 phút. Giả thiết quá trình đào thải thuốc là phản ứng bậc 1.
Đọc tiếp
Amoxicillin là thuốc kháng sinh có thể dùng để điều trị nhiễm khuẩn đường hô hấp trên, đường tiết niệu… Nồng độ tối thiểu có thể kháng khuẩn là 0,04 mg/1kg thể trọng. Khi kê đơn cho một bệnh nhân nặng 50kg, bác sĩ kê đơn mỗi lần uống 1 viên thuốc (có hàm lượng Amoxicilin 500 mg/viên). Bệnh nhân cần uống các viên thuốc tiếp theo cách lần đầu bao nhiêu lâu? Biết rằng chu kì bán hủy của Amoxicilin trong cơ thể người là 61 phút. Giả thiết quá trình đào thải thuốc là phản ứng bậc 1.
Hòa tan 2,8 gam CuO vào 140 gam dung dịch H2SO4 20 phần trăm
a. viết PTHH
b. Chất nào còn dư và dư bao nhiêu ?
c. tính C phần trăm các chất sau phản ứng.
------ giúp mình với nhé, thật sự rất căm ơn------
a)
$CuO + H_2SO_4 \to CuSO_4 + H_2O$
b)
n CuO = 2,8/80 = 0,035(mol)
n H2SO4 = 140.20%/98 = 2/7 (mol)
Ta thấy :
n CuO / 1 < n H2SO4 /1 nên H2SO4 dư
n H2SO4 pư = n CuO = 0,035(mol)
=> m H2SO4 dư = 140.20% - 0,035.98 = 24,57(gam)
c)
m dd = m CuO + m dd H2SO4 = 2,8 + 140 = 142,8(gam)
C% CuSO4 = 0,035.160/142,8 .100% = 3,92%
C% H2SO4 = 24,57/142,8 .100% = 17,2%
Đúng 3
Bình luận (1)








