Cho aluminium tác dụng vừa đủ với 73,5g đ H2SO4 20%
a. Tính khối lượng al cần dùng
b. tính thể tích khí h2 sinh ra(đkc0
Cho aluminium tác dụng vừa đủ với 73,5g đ H2SO4 20%
a. Tính khối lượng al cần dùng
b. tính thể tích khí h2 sinh ra(đkc0
\(m_{H2SO4}=14,7\left(g\right)\Rightarrow n_{H2SO4}=\dfrac{14,7}{98}=0,15\left(mol\right)\)
Pt : \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
0,1 0,15 0,15
a) \(m_{Al}=0,1.27=2,7\left(g\right)\)
b) \(V_{H2\left(dkc\right)}=0,15.24,79=3,7185\left(l\right)\)
Chúc bạn học tốt
\(C\%_{ddH_2SO_4}=\dfrac{m_{ct}}{m_{dd}}\cdot100\%=\dfrac{m_{ct}}{73,5}\cdot100\%=20\%\\ =>m_{H_2SO_4}=14,7\left(g\right)\\ n_{H_2SO_4}=\dfrac{m}{M}=\dfrac{14,7}{98}=0,15\left(mol\right)\\ PTHH;2Al+3H_2SO_4->Al_2\left(SO_4\right)_3+3H_2\)
tỉ lệ 2 : 3 : 1 : 3
n(mol) 0,1<----0,15--------->0,05--------->0,15
`n_(Al)=n*M=0,1*27=2,7(g)`
\(V_{H_2\left(dkc\right)}=n\cdot22,4=0,15\cdot24,79=3,7185\left(l\right)\)
cho 5,6 g Natri oxit tác dụng với nước thu được 2 lít dung dịch A Tính nồng độ mol của chất tan trong a
\(Na_2O+H_2O->2NaOH\\ n_{Na_2O}=\dfrac{5,6}{62}=0,0903\left(mol\right)\\ C_{M\left(NaOH\right)}=\dfrac{0,0903\cdot2}{2}=0,0903\left(M\right)\)
Na2O + H2O --> 2NaOH
nNa₂O = 5,6/62 = 0,09 (mol)
=> nNaOH = 0,18 (mol)
=> CM NaOH = 0,18/2 = 0,08 (M)
`n_(Na_2O)=(5,6)/62=0,9(mol)`
PTHH: `Na_2O+H_2O->2NaOH`
dd thu được là `NaOH`
`n_(NaOH)=2n_(Na_2O)=2.0,9=1,8(mol)`
Nồng độ mol dung dịch của NaOH: `C_M(NaOH)=(1,8)/2=0,9(M)`
Cho 1,6g Cuộc tác dụng với 200g dụng dịch h2so4 a.Tính khối lượng h2so4 phản ứng b.tính nồng độ % của h2so4 c.tính khối lượng muối thu đc
Sửa đề:
Cho 1,6g CuO tác dụng với 200g dụng dịch h2so4 a.Tính khối lượng h2so4 phản ứng b.tính nồng độ % của h2so4 c.tính khối lượng muối thu đc
Giải
\(a.n_{CuO}=\dfrac{1,6}{80}=0,02\left(mol\right)\\ CuO+H_2SO_4\xrightarrow[]{}CuSO_4+H_2\\ n_{H_2SO_4}=n_{CuSO_4}=n_{CuO}=0,02mol\\ m_{H_2SO_4}=0,02.98=1,96\left(g\right)\\ b.m_{ddH_2SO_4}=1,6+200=201,6\left(g\right)\\ C_{\%H_2SO_4}=\dfrac{1,96}{201,6}\cdot100\%\approx0,97\%\\ c.m_{CuSO_4}=0,02.160=3,2\left(g\right)\)
Cuộc là sao ?
CuO hả?
Helppp giúp em với 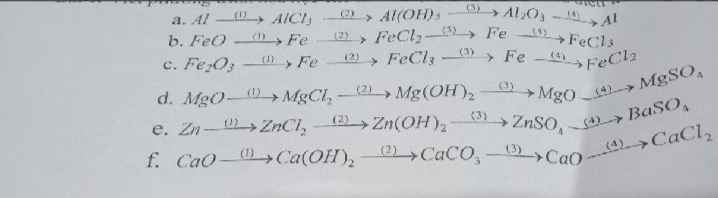
a)
$\rm (1)2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2$
$\rm (2)AlCl_3 + 3NaOh \rightarrow Al(OH)_3 \downarrow + 3NaCl$
$\rm (3)2Al(OH)_3 \xrightarrow{t^o} Al_2O_3 + 3H_2O$
$\rm (4)2Al_2O_3 \xrightarrow[Criolit]{t^o} 4Al + 3O_2 \uparrow$
b)
$\rm (1)FeO + H_2 \xrightarrow{t^o} Fe + H_2O$
$\rm (2)Fe + 2HCl \rightarrow FeCl_2 + H_2 \uparrow$
$\rm (3)FeCl_2 + Zn \rightarrow ZnCl_2 + Fe \downarrow$
$\rm (4)2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3$
c)
$\rm (1)Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O$
$\rm (2)2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3$
$\rm (3)FeCl_3 + Al_{dư} \rightarrow AlCl_3 + Fe \downarrow$
$\rm (4)Fe + 2HCl \rightarrow FeCl_2 + H_2 \uparrow$
d)
$\rm (1)MgO + 2HCl \rightarrow MgCl_2 + H_2O$
$\rm (2)MgCl_2 + 2KOH \rightarrow Mg(OH)_2 \downarrow + 2KCl$
$\rm (3)Mg(OH)_2 \xrightarrow{t^o} MgO + H_2O$
$\rm (4)MgO + H_2SO_4 \rightarrow MgSO_4 + H_2O$
e)
$\rm (1)Zn + 2HCl \rightarrow ZnCl_2 + H_2 \uparrow$
$\rm (2)ZnCl_2 + 2KOH \rightarrow Zn(OH)_2 \downarrow + 2KCl$
$\rm (3)Zn(OH)_2 + H_2SO_4 \rightarrow ZnSO_4 + 2H_2O$
$\rm (4) ZnSO_4 + BaCl_2 \rightarrow BaSO_4 \downarrow + ZnCl_2$
f)
$\rm (1)CaO + H_2O \rightarrow Ca(OH)_2$
$\rm (2)Ca(OH)_2 + Na_2CO_3 \rightarrow CaCO_3 \downarrow + 2NaOH$
$\rm (3)CaCO_3 \xrightarrow{t^o} CaO + CO_2 \uparrow$
$\rm (4)CaO + 2HCl \rightarrow CaCl_2 + H_2O$
Đề : Cho 15.2 gam hỗn hợp FeO, Fe2O3, Fe3O4 tác dụng vừa đủ với 0.25 lít dd HCl 2M thu được dd X . Tính nồng độ mol mỗi muối trong X ( chú thích : dd_ dung dịch )
Giúp em với ạ please 
Ta có: nCu(NO3)2 = 0,1.1,5 = 0,15 (mol)
nAgNO3 = 0,1.1,2 = 0,12 (mol)
nFe = 0,2 (mol)
PT: \(Fe+2AgNO_3\rightarrow Fe\left(NO_3\right)_2+2Ag\)
___0,06____0,12______0,06_______0,12 (mol)
\(Fe+Cu\left(NO_3\right)_2\rightarrow Fe\left(NO_3\right)_2+Cu\)
0,14___0,14__________0,14_____0,14 (mol)
⇒ Chất rắn A gồm: Ag: 0,12 (mol) và Cu: 0,14 (mol)
Dung dịch B gồm: Cu(NO3)2: 0,01 (mol) và Fe(NO3)2: 0,2 (mol)
a, mA = mAg + mCu = 21,92 (g)
b, \(\left\{{}\begin{matrix}C_{M_{Cu\left(NO_3\right)_2}}=\dfrac{0,01}{0,1}=0,1\left(M\right)\\C_{M_{Fe\left(NO_3\right)_2}}=\dfrac{0,2}{0,1}=1\left(M\right)\end{matrix}\right.\)
Một người làm vườn đã dùng 250g NH4NO3 để bón cho ruộng lúa b) Tính thành phần phần trăm chất dinh dưỡng c) Tính khối lượng của nguyên tố dinh dưỡng bón cho ruộng lúa GIÚP EM VỚIIIII Ạ
Cho 17,1 gam Ba(oh) 2 vào đ h2so4 loãng dư . Tính khối lượng muối đc tạo ra
Ta có: \(n_{Ba\left(OH\right)_2}=\dfrac{17,1}{171}=0,1\left(mol\right)\)
PT: \(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\)
Theo PT: \(n_{BaSO_4}=n_{Ba\left(OH\right)_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{BaSO_4}=0,1.233=23,3\left(g\right)\)
Hòa tan 15g CuSO4 vào 185g nước. Tính phần trăm dung dịch thu được theo 2 cách
giải hộ em với ạ.
Ta có: \(C\%_{CuSO_4}=\dfrac{15}{15+185}.100\%=7,5\%\)
Lần đầu sử dụng hơi bỡ ngỡ nha
1/ Cho 19,5 ( ZN ) tác dụng với HCL
a/ Viết PTHH của phản ứng trên?
b/ Tính thể tích khí hydrogen sinh ra ( ở 25 độ C, 1 bar )
c/ Tính khối lượng muối thu được? Gọi tên muối?
Zn = 65 , H = 1 , Cl = 35.5
2/ Cho 5,6 Fe tác dụng với H2SO4
a/ Viết PTHH của phản ứng trên
b/ Tính thể tích khí hydrogen sinh ra ( ở 25 độ C , 1 bar )
c/ Tính khối lượng muối thu được? Gọi tên muối?
Fe = 56 , H = 1 , O = 16
1) a) `Zn + 2HCl -> ZnCl_2 + H_2`
b) `n_{Zn} = (19,5)/(65) = 0,3 (mol)`
Theo PT: `n_{ZnCl_2} = n_{H_2} = n_{Zn} = 0,3 (mol)`
`=> V_{H_2} = 0,3.24,79 = 7,437 (l)`
c) Tên muối: kẽm clorua
`m_{ZnCl_2} = 0,3.136 = 40,8 (g)`
2) a) `Fe + H_2SO_4 -> FeSO_4 + H_2`
b) `n_{Fe} = (5,6)/(56) = 0,1 (mol)`
Theo PT: `n_{FeCl_2} = n_{H_2} = n_{Fe} =0,2 (mol)`
`=> V_{H_2} = 0,2.24,79 = 4,958 (l)`
c) Tên muối: sắt (II) clorua
`m_{FeCl_2} = 0,2.127 = 25,4 (g)`
Lâu quá ko học nên quên cách làm mn giúp ạ :((