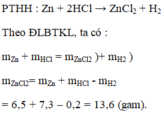hoà tan 6,5 gam kẽm vào 70g dung dịch chứa axit HCLđược muối lẽm clorua và khí hidro thoát ra
CC
Những câu hỏi liên quan
Hòa tan hoàn toàn 6,5 gam kẽm vào dung dịch axit clohidric HCl có chứa 7,3 gam HCl (vừa đủ). Sau phản ứng thu được dung dịch muối kẽm clorua và 0,2 gam khí hidro.
a) Lập công thức hóa học của muối kẽm clorua. Biết kẽm clorua do hai nguyên tố là Zn và Cl tạo ra.
b) Tính khối lượng muối kẽm clorua tạo thành.
a) Lập công thức hóa học của muối kẽm clorua: Z n C l 2
b) Khối lượng muối Z n C l 2 = 6,5 + 7,3 – 0,2 = 13,6 (gam)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 6,5 gam kẽm vào dung dịch axit clohidric HCl có chứa 7,3 gam HCl (vừa đủ). Sau phản ứng thu được dung dịch muối kẽm clorua và 0,2 gam khí hidro,
Viết phản ứng hóa học xảy ra.
Tính khối lượng kẽm clorua Z n C l 2 tào thành.
Hòa tan 6,5 gam Zn vào dung dịch axit sunfuric loãng thu được muối kẽm clorua Zncl2 và khí hidro H2
a) tính khối lượng muối kẽm clorua thu được
b)tính thể tích khí Hiđro sinh ra
Hoà tan hoàn toàn 6,5 g kẽm bằng dung dich axit clohiđric thu được muối kẽm clorua (ZnCl2) và khí hidro.
a) Tính thể tích khí H2 sinh ra (đktc)?
b) Tính khối lượng dung dịch axit clohiđric 10% đã phản ứng?
c) Nếu dùng toàn bộ lượng H2 trên để khử 16 gam sắt (III) oxit thì thu được bao nhiêu gam sắt?
Giải gấp giùm mik
\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1
\(V_{H_2}=0,1.22,4=2,24l\\
m_{HCl}=\left(0,2.36,5\right).10\%=0,73g\)
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\\
pthh:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\\
LTL:\dfrac{0,1}{1}>\dfrac{0,1}{3}\)
=> Fe2O3 dư
\(n_{Fe}=\dfrac{2}{3}n_{H_2}=0,067\left(mol\right)\\
m_{Fe}=0,067.56=3,73g\)
Đúng 6
Bình luận (1)
a.b.\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 ( mol )
\(V_{H_2}=0,1.22,4=2,24l\)
\(m_{ddHCl}=\dfrac{0,2.36,5}{10\%}=73g\)
c.\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,1 > 0,1 ( mol )
0,1 1/15 ( mol )
\(m_{Fe}=\dfrac{1}{15}.56=3,73g\)
Đúng 6
Bình luận (2)
Hoà tan hết 6,5 gam Kẽm vào 150ml dung dịch axit sunfuric loãng (khối lượng riêng D= 1,08 g/ml)
a/ Tính thể tích khí thoát ra(đktc)?
b/ Tính nồng độ phần trăm của muối có trong dd sau phản ứng
\(n_{Zn}=\dfrac{6.5}{65}=0.1\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(0.1......................0.1..........0.1\)
\(V_{H_2}=0.1\cdot22.4=2.24\left(l\right)\)
\(m_{dd_{H_2SO_4}}=150\cdot1.08=162\left(g\right)\)
\(m_{dd}=6.5+162-0.1\cdot2=168.3\left(g\right)\)
\(C\%_{ZnSO_4}=\dfrac{0.1\cdot161}{168.3}\cdot100\%=9.56\%\)
Đúng 2
Bình luận (4)
Hòa tan hoàn toàn 6,5 gam kim loại kẽm bằng 1 lượng vừa đủ dung dịch axit clohidric (HCl), sau phản ứng thu được khí Hidro và muối kẽm clorua (ZnCl2).
a) Viết phương trình hóa học xảy ra?
b) Tính thể tích khí hidro thu được sau phản ứng ở đktc?
c) Tính khối lượng HCl đã phản ứng?
a. \(n_{Zn}=\dfrac{6.5}{65}=0,1\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,1 0,2 0,1
b. \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c. \(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
Đúng 4
Bình luận (0)
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{HCl}=0,2\cdot36,5=7,3g\)
Đúng 2
Bình luận (0)
hoà tan hoàn toàn 6,5 kim loại kẽm zn vào dung dịch axit clohidric HCL 10%(vừa đủ) tính thể tích hidro thoát ra(đktc)
nZn = 6.5/65 = 0.1 (mol)
Zn + 2HCl =>ZnCl2 + H2
0.1..............................0.1
VH2 = 0.1 * 22.4 = 2.24 (l)
Đúng 2
Bình luận (0)
Hòa tan vừa đủ 13 g kẽm trong dung dịch axit clohiđric thu được muối kẽm Clorua và khí hidro a Viết phương trình phản ứng b Tính khối lượng clorua c Tính thể tích khí hidro thoát ra ở điều kiện tiêu chuẩn
Xem chi tiết
a)
\(Zn + 2HCl \to ZnCl_2 + H_2\)
b),c)
Theo PTHH :
\(n_{ZnCl_2} = n_{H_2} = n_{Zn} = \dfrac{13}{65} = 0,2(mol)\)
Vậy :
\(m_{ZnCl_2} = 0,2.136 = 27,2(gam)\\ V_{H_2} =0,2.22,4 = 4,48(lít)\)
Đúng 1
Bình luận (3)
a) PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
b+c)
Ta có: \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)=n_{ZnCl_2}=n_{H_2}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{ZnCl_2}=0,2\cdot136=27,2\left(g\right)\\V_{H_2}=0,2\cdot22,4=4,48\left(l\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
cho 26 kim loại kẽm tác dụng với 200 gam dung dịch axit clohiđric thu được muối kẽm clorua và khí hidro thoát ra
tính thể tích khí hiđro sinh ra
tính khối lượng của muối kẽm clorua tạo thành
tính nồng độ phần trăm của dung dịch axit hidric
a) \(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,4-->0,8----->0,4--->0,4
=> VH2 = 0,4.22,4 = 8,96 (l)
b) mZnCl2 = 0,4.136 = 54,4 (g)
c) \(C\%=\dfrac{0,8.36,5}{200}.100\%=14,6\%\)
Đúng 3
Bình luận (0)