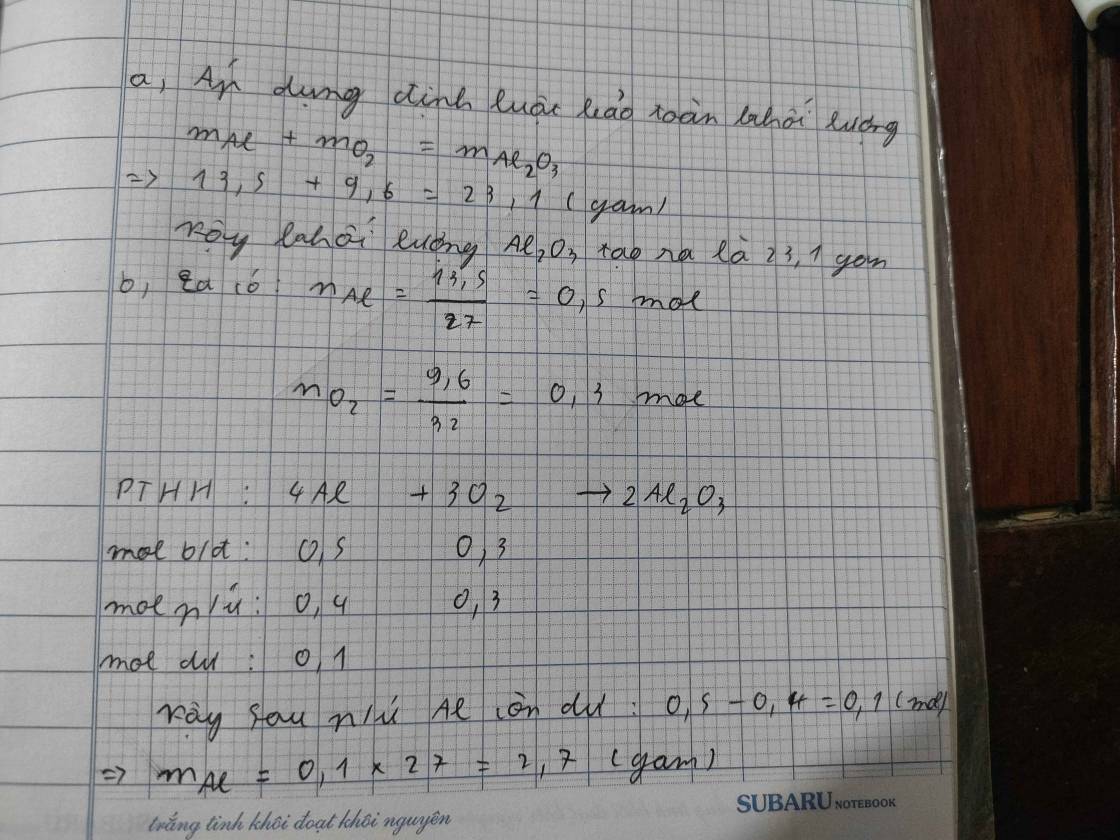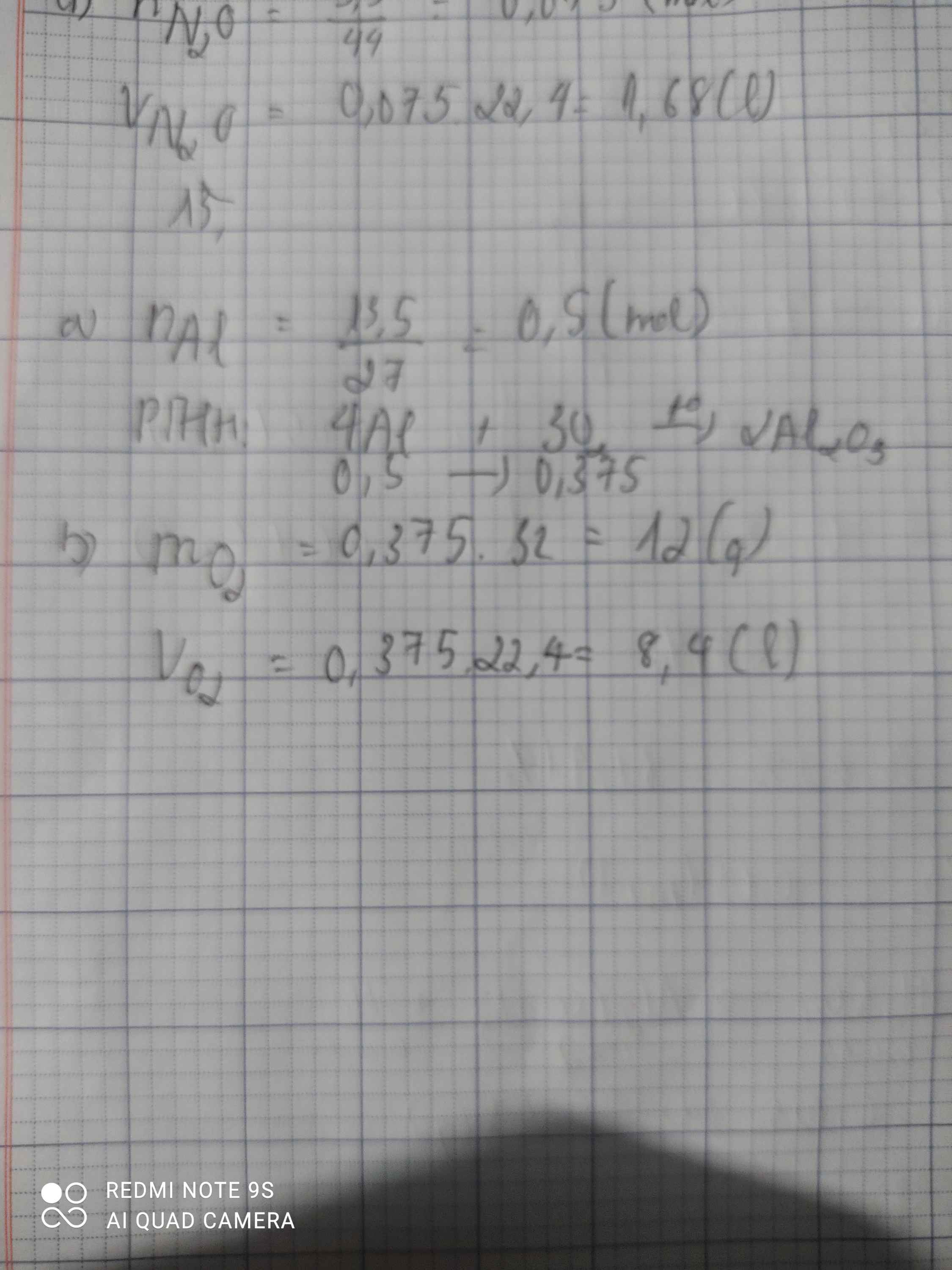cho Al tác dụng với 3,2 (g) O2 sinh ra 10,2 g một chất .tính mal T/G phản ứng
ND
Những câu hỏi liên quan
cho S,P,N2,C,Al Viết phương trình phản ứng với O2 cho Al tác dụng với 3,2 (g) O2 sinh ra 10,2 g một chất .tính mal T/G phản ứng
\(S+O_2\rightarrow\left(t^o\right)SO_2\\ 4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\\2 N_2+5O_2\rightarrow\left(3000^oC\right)2N_2O_5\\ C+O_2\rightarrow\left(t^o\right)CO_2\\ 4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ ----\\ 4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ n_{O_2}=\dfrac{3,2}{32}=0,1\left(mol\right);n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\\ Vì:\dfrac{0,1}{3}< \dfrac{0,1}{2}\Rightarrow Xem.lại.đề\)
Đúng 0
Bình luận (0)
Cho 13,5 g Al tác dụng với 9,6 g O2, tạo ra Al2O3.
a) Tính khối lượng Al2O3 tạo ra
b) Sau phản ứng dư chất nào, tính khối lượng chất dư đó?
Cho 13,5 g kim loại al tác dụng với o2 sinh ra nhôm axit a) viết phản ứng hóa học b) tính khối lượng và thể tích của oxi tham gia phản ứng
\(n_{Al}=\dfrac{13,5}{27}=0,5\left(mol\right)\\a, 4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ n_{O_2}=\dfrac{3}{4}.0,5=0,375\left(mol\right)\\ m_{O_2}=32.0,375=12\left(g\right)\\ V_{O_2\left(đktc\right)}=0,375.22,4=8,4\left(l\right)\)
Đúng 3
Bình luận (3)
cho 5,4(g) Al tác dụng với 6,4(g) O2. Tính khối lượng các chất sau phản ứng
nAl = \(\dfrac{5,4}{27}=0,2\) mol
nO2 = \(\dfrac{6,4}{32}=0,2\) mol
Pt: 4Al + 3O2 --to--> 2Al2O3
0,2 mol->0,15 mol-> 0,1 mol
Xét tỉ lệ mol giữa Al và O2:
\(\dfrac{0,2}{4}< \dfrac{0,2}{3}\)
Vậy O2 dư
mAl2O3 = 0,1 . 102 = 10,2 (g)
mO2 dư = (0,2 - 0,15) . 32 = 1,6 (g)
Đúng 0
Bình luận (0)
4Al + 3O2 + 2Al2O3
0,2 0,15 0,1
nAl = m/M=5,4/27=0,2
mAl2O3= n.M=0,1×(27×2+16×3)=10,2g
Đúng 0
Bình luận (0)
nAl = 0,2 mol
nO2 = 0,2 mol
4Al + 3O2 → 2Al2O3
Đặt tỉ lệ ta có
\(\dfrac{0,2}{4}\) < \(\dfrac{0,2}{3}\)
⇒ O2 dư
⇒ mAl2O3 = 0,1.102 = 10,2 (g)
⇒ mO2 dư = ( 0,2-0,15 ).32 = 1,6 (g)
Đúng 0
Bình luận (0)
Cho 8,1g Al tác dụng với dung dịch có chứa 21,9g HCl
a) Viết PTPU
b) Sau phản ứng chất nào dư? Dư bao nhiêu g?
c) Tính khối lượng AlCl3 tạo thành
d) Lượng khí hidro sinh ra trên có thể khử đc bao nhiêu g CuO
\(n_{Al}=\dfrac{8,1}{27}=0,3(mol);n_{HCl}=\dfrac{21,9}{36,5}=0,6(mol)\\ a,PTHH:2Al+6HCl\to 2AlCl_3+3H_2\\ LTL:\dfrac{0,3}{2}>\dfrac{0,6}{6}\Rightarrow Al\text { dư}\\ n_{Al(dư)}=0,3-\dfrac{0,6}{3}=0,1(mol)\\ \Rightarrow m_{Al(dư)}=0,1.27=2,7(g)\\ c,n_{AlCl_3}=\dfrac{1}{3}n_{HCl}=0,2(mol)\\n_{H_2}=\dfrac{1}{2}n_{HCl}=0,3(mol)\\ \Rightarrow m_{AlCl_3}=0,2.133,5=26,7(g)\\ d,V_{H_2}=0,3.22,4=6,72(l)\)
Đúng 2
Bình luận (0)
Cho 13,7 g Ba tác dụng hết với 3,2 g oxi thu được hợp chất oxit. Tính khối lượng oxi còn lại sau phản ứng.
A. 3,2 g
B. 1,6 g
C. 6,4 g
D. 0,8 g
Đáp án B

Khối lượng oxi sau phản ứng là m = 0,05.32 = 1,6 g
Đúng 0
Bình luận (0)
Cho 2,7 g nhôm tác dụng với 6,4 g
O
2
. Đến khi phản ứng xảy ra hoàn toàn, xác định sản phẩm thu được và chất còn dư sau phản ứng? A.
A
l
2
O
3
B. Al C.
O
2
D.
A
l
2
O
3
v
à
...
Đọc tiếp
Cho 2,7 g nhôm tác dụng với 6,4 g O 2 . Đến khi phản ứng xảy ra hoàn toàn, xác định sản phẩm thu được và chất còn dư sau phản ứng?
A. A l 2 O 3
B. Al
C. O 2
D. A l 2 O 3 v à O 2 dư
Đáp án D
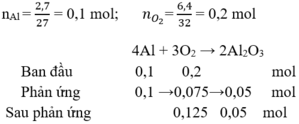
Vậy sau phản ứng thấy A l 2 O 3 v à O 2 dư
Đúng 0
Bình luận (0)
Cho 5,4 g Al tác dụng hết dd H2SO4 3M a) Tìm g muối sinh ra b) Tìm Vkhí bay ra (đkc) c) Tính Vdd axit phản ứng
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Pt : \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
0,2 0,3 0,1 0,3
a) \(m_{muối}=m_{Al2\left(SO4\right)3}=0,1.342=34,2\left(g\right)\)
b) \(V_{H2\left(dktc\right)}=0,3.22,4=6,72\left(l\right)\)
c)\(V_{ddH2SO4}=\dfrac{0,3}{3}=0,1\left(l\right)\)
Chúc bạn học tốt
Đúng 2
Bình luận (0)
2 Al + 3 H2SO4 -----> Al2(SO4)3 + 3 H2
0,2 : 0,3 : 0,1 : 0,3 (mol)
nAl= \(\dfrac{5,4}{27}\approx0,2\) (mol)
a) mAl2(SO4)3 = 0,1.342 = 34,2 (g)
b) VH2 = 0,3.22,4 = 6,72 (lít)
c) VH2SO4 = \(\dfrac{0,3}{3}=0,1\) (lít)
Đúng 0
Bình luận (0)
Cho Al tác dụng với O2 thu được 10,2 gam Al2O3. Khối lượng O2 đã phản ứng là:
\(n_{Al_2O_3}=\dfrac{10,2}{102}=0,1mol\\ 4Al+3O_2\xrightarrow[]{t^0}2Al_2O_3\\ n_{O_2}=\dfrac{0,1.3}{2}=0,15mol\\ m_{O_2}=0,15.32=4,8g\)
Đúng 1
Bình luận (0)