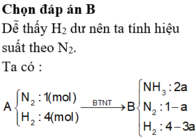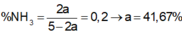trộn 9 mol N2 + 6 mol H2 để tổng hợp NH3 thu được 14 mol hỗn hợp khí sau phản ứng . tính H%
HT
Những câu hỏi liên quan
Cho 9 mol N2 và 6 mol H2 vào bình tổng hợp thu được khí NH3. Tính thànhphần % theo thể tích của các khí có trong hỗn hợp sau phản ứng và hiệu suất phản ứng. Biết rằng hỗn hợp sau phản ứng có tổng số mol là 14
\(N_2+3H_2\leftrightarrow2NH_3\\ n_{NH_3}=a\left(mol\right)\\ n_{sau}=14=9-\dfrac{1}{2}a+6-\dfrac{3}{2}a+a\\ a=1\\ n_{N_2}:1>n_{H_2}:3\\ H=\dfrac{1}{\dfrac{2}{3}.6}.100\%=25\%\)
Đúng 1
Bình luận (0)
Cho V lít (đktc) hỗn hợp khí
N
2
và
H
2
có tỉ lệ mol 1:4 vào bình kín và nung nóng. Sau phản ứng thu được 1,5 mol
NH
3
. Biết hiệu suất phản ứng là H 25%. Giá trị của V là A. 42 lít. B. 268,8 lít. C. 336 lít. D. 448 lít.
Đọc tiếp
Cho V lít (đktc) hỗn hợp khí N 2 và H 2 có tỉ lệ mol 1:4 vào bình kín và nung nóng. Sau phản ứng thu được 1,5 mol NH 3 . Biết hiệu suất phản ứng là H = 25%. Giá trị của V là
A. 42 lít.
B. 268,8 lít.
C. 336 lít.
D. 448 lít.
Chọn C
Giả sử phản ứng xảy ra với H = 100% → N 2 hết →Hiệu suất tính theo N 2 .
Đặt số mol N 2 ban đầu là x mol, n N 2 ban đầu = 4x mol;
Do hiệu suất phản ứng là 25% nên n N 2 pứ = 25%.x = 0,25x mol
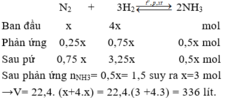
Đúng 1
Bình luận (0)
Khi phản ứng .N2 (k) + 3H2 (k)
⇄
2NH3 (k) đạt đến trạng thái cân bằng thì hỗn hợp khí thu được có thành phần. 1,5 mol NH3, 2 mol N2 và 3 mol H2. Vậy số mol ban đầu của H2 là. A. 3 mol B. 4 mol C. 5,25 mol D. 4,5 mol
Đọc tiếp
Khi phản ứng .N2 (k) + 3H2 (k) ⇄ 2NH3 (k) đạt đến trạng thái cân bằng thì hỗn hợp khí thu được có thành phần. 1,5
mol NH3, 2 mol N2 và 3 mol H2. Vậy số mol ban đầu của H2 là.
A. 3 mol
B. 4 mol
C. 5,25 mol
D. 4,5 mol
Đáp án C.
N2 (k) + 3H2 (k) ⇄ t o , x t , p 2NH3 (k)
Cân bằng: 2 3 1,5 (mol)
phản ứng : 0,75 2,25 1,5
ban đầu: 2,75 5,25 0
Đúng 0
Bình luận (0)
Cho 0,2 mol N2 tác dụng với 0,6 mol H2 thì thu được 0,6 mol hỗn hợp N2, H2, NH3. Hiệu suất của phản ứng tổng hợp NH3 là:
A.25%
B.75%
C.50%
D.80%
C
N2+3 H2 -> 2 NH3
0.2 0.6 0.4
x 3x 2x
x+3x+2x=0.6
x=0.1
H=(0.1*2)*100/0.4=50%
N2 + 3H2 ⇌ 2NH3
nban đầu 0,2___0,6
np ứng___x——>3x——->2x
nsau pứ. (0,2-x) (0,6-3x) 2x
sau phản ứng thu đc 0,6 mol N2, H2 và NH3
=> (0,2-x)+ (0,6-3x) + 2x = 0,6
=> x = 0,1
=> N2 dư ít hơn H2 (0,1<0,3).
=> Hiệu suất tính theo N2
=> H =0,1/0,2x100% =50%
Hỗn hợp A gồm N2 và H2 có tỷ lệ số mol tương ứng là 1:4. Nung A với xúc tác thích hợp thu được hỗn hợp khí B, trong đó NH3 chiếm 20% về thể tích. Hiệu suất của phản ứng tổng hợp NH3 là: A. 10,41%. B. 41,67%. C. 20,83%. D. 43,76%.
Đọc tiếp
Hỗn hợp A gồm N2 và H2 có tỷ lệ số mol tương ứng là 1:4. Nung A với xúc tác thích hợp thu được hỗn hợp khí B, trong đó NH3 chiếm 20% về thể tích. Hiệu suất của phản ứng tổng hợp NH3 là:
A. 10,41%.
B. 41,67%.
C. 20,83%.
D. 43,76%.
Trong một bình kín chứa 8 mol khí H2 và 3 mol khí N2 và một ít bột Ni làm xúc tác. Nung nóng bình trong một thời gian tới khi có 60% thể tích H2 phản ứng thì thu được hỗn hợp khí A (gồm N2, H2 và NH3).
a/ Tính thể tích NH3 tạo thành (đktc).
b/ Tính tỉ khối của A đối với H2.
a) \(N_2+3H_2-^{t^o}\rightarrow2NH_3\)
3..........8
Lập tỉ lệ \(\dfrac{3}{1}>\dfrac{8}{3}\) => Tính theo số mol H2
\(n_{H_2\left(pứ\right)}=8.60\%=4,8\left(mol\right)\)
=> \(n_{NH_3}=\dfrac{4,8.2}{3}=3,2\left(mol\right)\)
=> \(V_{NH_3}=3,2.22,4=71,68\left(l\right)\)
b) Hỗn hợp A gồm N2 dư, H2 dư, NH3
\(n_{N_2\left(dư\right)}=3-\dfrac{4,8}{3}=1,4\left(mol\right)\)
\(n_{H_2\left(dư\right)}=8-4,8=3,2\left(mol\right)\)
\(M_A=\dfrac{3,2.2+1,4.28+3,2.17}{3,2+1,4+3,2}=12,82\)
=>dA/H2 \(=\dfrac{12,82}{2}=6,41\)
Đúng 2
Bình luận (0)
Cho 5 lít khí N2 tác dụng với 5 lít khí H2 ở nhiệt độ cao, xúc tác thích hợp để tổng hợp khí NH3. Sau phản ứng thu được 7 lí hỗn hợp khí X gồm N2, H2, NH3. Tính thể tích mỗi khí trong hỗn hợp X thu được và hiệu suất phản ứng tổng hợp NH3. Biết các khí đo ở cùng điều kiện nhiệt độ và áp suất
N2 + 3H2 \(\overset{t^o,p,xt}{⇌}\) 2NH3.
Cứ 1 lít N2 tác dụng với 3 lít H2 tạo ra 2 lít NH3. Vậy a lít N2 tác dụng với 3a lít H2 tạo ra 2a lít NH3, thu được (5-a)+(5-3a)+2a=7 (lít), suy ra a=1,5 (lít).
Thể tích mỗi khí trong hỗn hợp X gồm khí N2 (5-1,5=3,5 (lít)), khí H2 (5-3.1,5=0,5 (lít)) và khí NH3 (2.1,5=3 (lít)).
Hiệu suất phản ứng là H=(5-0,5)/5.100%=90% (hiệu suất tính theo H2 do H2 thiếu).
Đúng 2
Bình luận (0)
Cho 1 mol N2 và 4 mol H2 vào bình phản ứng, sau một thời gian thu được 3,5 mol hỗn hợp khí
trộn 0,2 mol H2 và 0,08 mol O2 thu được hỗn hợp khí X nung nóng X để phản ứng xảy ra với hiệu suất 75% thì thu được hỗn hợp Y gồm khí và hơi Tính khối lượng mỗi chất có trong y