Tìm khối lượng ban đầu của một oxit
0H
Những câu hỏi liên quan
Nung nóng 25,4 gam h² Cu(Oh)2 Al(OH)3 đếm khối lượng ko đổi thu 18,2 gam Tìm khối lượng muối oxit o h² ban đầu
PTHH:
\(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
\(2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
Theo giả thiết ta có:
\(98n_{Cu\left(OH\right)_2}+78n_{Al\left(OH\right)_3}=25,4\left(1\right)\)
Mặt khác: \(\left\{{}\begin{matrix}n_{Cu\left(OH\right)_2}=n_{CuO}\\n_{Al\left(OH\right)_3}=2n_{Al_2O_3}\end{matrix}\right.\)
Khi đó:
\(80n_{CuO}+102n_{Al_2O_3}=18,2\)
\(\Leftrightarrow80n_{Cu\left(OH\right)_2}+51n_{Al\left(OH\right)_3}=18,2\left(2\right)\)
Giải hệ hai phương trình (1) và (2) ta được:
\(\left\{{}\begin{matrix}n_{Cu\left(OH\right)_2}=0,1\left(mol\right)\\n_{Al\left(OH\right)_3}=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Cu\left(OH\right)_2}=9,8\left(g\right)\\n_{Al\left(OH\right)_3}=15,6\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Đề phải là tìm khối lượng mỗi bazo trong hỗn hợp ban đầu hoặc oxit trong hỗ hợp sau nhiệt phân chứ.
Đúng 0
Bình luận (0)
Hoà tan một oxit kim loại hoá trị x bằng 400ml dd HNO3 0,2M.Sau phản ứng dd làm đỏ quỳ tím và phải trung hoà bằng 50g dd nước vôi trong 1,48% rồi cô cạn dung dịch nhận được 6,48g muối nitrat khô. Tìm công thưc oxit ban đầu và khối lượng của nó
Đốt cháy hoàn toàn một hỗn hợp A gồm Mg và Cu (Trong đó khối lượng của Cu hơn khối lượng của Mg là 13,6 g ) thu được hỗn hợp 2 Oxit MgO có khối lượng là 28g. Tính khối lượng của mỗi kim loại ban đầu.
2Mg+ O2--->2MgO(1)
x(24x)--------x(40x)
2Cu+O2---->2CuO(2)
y(64y)-----------y(80y)
Theo bài ra
-24x+64y=13,6(1)
40x+80y=28(2)
Giair 1 và 2 ta dc
x=0,16...Y=0,27
=> m\(_{Cu}=64.0,27=17,28\left(g\right)\)
m\(_{Mg}=28-17,28=10,72\)
Đúng 0
Bình luận (0)
Khử hoàn toàn 16 gam bột oxit sắt bằng khí CO ở nhiệt độ cao. Sau phản ứng khối lượng khí thu được tăng thêm so với khối lượng khí ban đầu 4,8 gam. Công thức của oxit sắt là A.
F
e
2
O
3
. B. FeO. C.
F
e
O
2
. D.
F
e
3
O
4
.
Đọc tiếp
Khử hoàn toàn 16 gam bột oxit sắt bằng khí CO ở nhiệt độ cao. Sau phản ứng khối lượng khí thu được tăng thêm so với khối lượng khí ban đầu 4,8 gam. Công thức của oxit sắt là
A. F e 2 O 3 .
B. FeO.
C. F e O 2 .
D. F e 3 O 4 .
Cho khí hidro qua bột sắt (III) oxit (Fe2O3). Lượng khí hidro này là sản phẩm của 6(g) magie phản ứng với dung dịch axit clohidric (HCl) . Tính khối lượng sắt (III) oxit ban đầu
Mg+2HCl->MgCl2+H2
0,25--------------------0,25 mol
3H2+Fe2O3-to>2Fe+3H2O
0,25-----1\12-------------1\6 mol
n Mg=6\24=0,25 mol
=>m Fe=1\6 .56=9,33g
=>m Fe2O3=1\12.160=13.33g
Đúng 0
Bình luận (0)
\(n_{Mg}=\dfrac{6}{24}=0,25\left(mol\right)\)
PTHH: Mg + 2HCl → MgCl2 + H2
Mol: 0,25 0,25
PTHH: Fe2O3 + 3H2 → 2Fe + 3H2O
Mol: 1/12 0,25
\(m_{Fe_2O_3}=\dfrac{1}{12}.160=13,33\left(g\right)\)
Đúng 0
Bình luận (0)
Dẫn luồng khí H 2 dư đi qua 16 g hỗn hợp hai oxit CuO và F e 2 O 3 . nung nóng. Sau phản ứng để nguội, cân lại thấy khối lượng hỗnn hợp giảm 25%. Tính phần trăm khối lượng của mỗi oxit trong hỗn hợp ban đầu.
Phương trình hóa học:
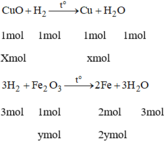
Gọi x là số mol của CuO
y là số mol của F e 2 O 3 .
Ta có: 80x + 160y = 16 (1)
Khối lượng hỗn hợp giảm do oxit tạo thành kim loại:
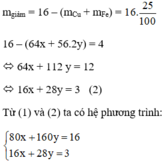
Giải hệ phương trình ta được:
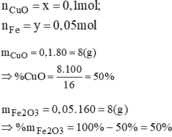
Đúng 0
Bình luận (0)
cho 81g kẽm oxit tan hết trong dung dịch HCl,sau phản ứng khối lượng dung dịch thu được là 216g.Hãy tính khối lượng của dung dịch HCl ban đầu
\(ZnO+2HCl->H_2O+ZnCl_2\)
1 2
\(n_{ZnO}=\frac{m}{M}=\frac{81}{81}=1mol\)
\(m_{HCl}trước-phản-ứng=n.M=2.36,5=73\)
ĐÂY CHỈ LÀ CÁCH 1 THÔI !!! BN CŨNG CÓ THỂ LÀM THEO CÁCH 2 ĐÓ !!!
Đúng 0
Bình luận (0)
Cho 9,1g hh hai oxit AL2O3 và MgO tác dụng vừa đủ với 250ml dd axit HCl 2M
a, Tính khối lượng của mỗi oxit trong hh ban đầu
b, Tính thành phần % khối lượng của oxit trong hh
Ta có:
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
x 6x
=> \(m_{Al_2O_3}=x.\left(27.2+16.3\right)=102.x\left(g\right)\)
\(MgO+2HCl\rightarrow MgCl_2+H_2\)
y 2y
=> \(m_{MgO}=y.\left(24+16\right)=40y\)
\(n_{HCl}=2.0,25=0,5mol\)
Ta có tỉ lệ
120x+40y= 9,1 (1)
2y+6x= 0,5
còn lại xuy ra x và y
.... ( bận nên không làm tiếp được)
Đúng 0
Bình luận (0)
Gọi x,y là số mol Al2O3 và MgO. ĐK: x,y>0.
PTHH: Al2O3+ 6HCl-----> AlCl3+ H2O
............x................6x(mol)
MgO+ 2HCl---> MgCl2+ H2
y............2y(mol),;
=>K/l MgO:
m(MgO)=y(24+16)=40y
Số mol HCl:
nHCl=2.0,25=0,5(mol)
Ta có: 102x+40y=9,1;6x+2y=0,5
=>x=0,05;y=0,1(TM)
=> nAl2O3=0,05(mol)l; nHCl=0,1(mol)
=> mAl2O3=5,1(g); mHCl=3,65(g)
\(\%_{Al_2O_3}=\frac{5,1}{9,1}.100\%\approx56,04\left(\%\right)\)
\(\%_{MgO}=100\%-56,04\%=43,96\left(\%\right)\)
#Walker
Đúng 0
Bình luận (0)
Al2O3 +6 HCl------> 2AlCl3 + 3H2O
x----------6x-------------2x-----------3x
MgO + 2HCl------> MgCl2 +H2
y---------2y-------------y--------y
Gọi n\(_{Al2O3}=x\Rightarrow m_{Al2O3}=102=102x\left(g\right)\)
Gọi n\(_{MgO}=y\Rightarrow m_{MgO}=40y\)
theo bài ra ta có hệ pt
\(\left\{{}\begin{matrix}102x+40y=9,1\\6x+2y=0,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,05\\y=0,1\end{matrix}\right.\)
m\(_{Al2O3}=102.0,05=5,1\left(g\right)\)
m\(_{Mg}=9,1-5,1=4\left(g\right)\)
b) %m\(_{Al2O3}=\frac{5,1}{9,1}.100\%=56\%\)
%m\(_{MgO}=100\%-56\%=44\%\)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Bài 2) 200ml dung dịch HCl có nồng độ 3.5M hòa tan vừa hết 20g hỗn hợp hai oxit CuO và Fe2O3
a) Viết phương trình hóa học
b) Tính khối lượng của mỗi oxit có trong hỗn hợp ban đầu
c) Tính thành phần trăm theo khối lượng của mỗi oxit có trong hỗn hợp ban đầu








