Viết phương trình hóa học biểu diễn sự chuyển đổi giữa kim loại và hợp chất vô cơ
H24
Những câu hỏi liên quan
Bài 1: Viết các PTHH biểu diễn1. Sự chuyển đổi của kim loại với các loại hợp chất vô cơ:a/ Kim loại → muốib/ Kim loại → oxit bazơ → bazơ → kim loại2. Sự chuyển đổi các loại hợp chất vô cơ thành kim loại:a/ Muối → kim loạib/ Muối → bazơ → oxit bazơ → kim loại Bài 2: Viết các PTHH biểu diễn các chuyển đổi sau:a/ Fecl2 → Fe(OH)2 → FeSO4 → Fe → Fe3O4 → Feb/ Al → Al2O3 → AlCl3 → Al(OH)3 → Al2O3 → Al → NaAlO2c/ Cl2 → FeCl3 → Fe(OH)3 → Fe2O3 ↓ NaClO
Đọc tiếp
Bài 1: Viết các PTHH biểu diễn
1. Sự chuyển đổi của kim loại với các loại hợp chất vô cơ:
a/ Kim loại → muối
b/ Kim loại → oxit bazơ → bazơ → kim loại
2. Sự chuyển đổi các loại hợp chất vô cơ thành kim loại:
a/ Muối → kim loại
b/ Muối → bazơ → oxit bazơ → kim loại
Bài 2: Viết các PTHH biểu diễn các chuyển đổi sau:
a/ Fecl2 → Fe(OH)2 → FeSO4 → Fe → Fe3O4 → Fe
b/ Al → Al2O3 → AlCl3 → Al(OH)3 → Al2O3 → Al → NaAlO2
c/ Cl2 → FeCl3 → Fe(OH)3 → Fe2O3
↓
NaClO
Bài 1:
Ý 1)
\(a,Mg+H_2SO_4\rightarrow MgSO_4+H_2\\ b,\left(1\right)4K+O_2\rightarrow2K_2O\\ \left(2\right)K_2O+H_2O\rightarrow2KOH\\ \left(2\right)Bazo\rightarrow KL\left(K.có\right)\)
Ý 2)
\(a,Mg+FeSO_4\rightarrow MgSO_4+Fe\\ b,CuSO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+Cu\left(OH\right)_2\\ Cu\left(OH\right)_2\rightarrow\left(t^o\right)CuO+H_2O\\ CuO+CO\rightarrow\left(t^o\right)Cu+CO_2\)
Đúng 2
Bình luận (1)
Bài 2:
\(a,\left(1\right)FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\\ \left(2\right)Fe\left(OH\right)_2+H_2SO_4\rightarrow FeSO_4+2H_2O\\ \left(3\right)FeSO_4+Zn\rightarrow ZnSO_4+Fe\\ \left(4\right)3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\\ \left(4\right)Fe_3O_4+4CO\rightarrow\left(t^o\right)3Fe+4CO_2\)
Đúng 1
Bình luận (0)
Bài 2b)
\(\left(1\right)4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ \left(2\right)Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\\ \left(3\right)AlCl_3+3KOH\rightarrow Al\left(OH\right)_3+3KCl\\ \left(4\right)2Al\left(OH\right)_3\rightarrow\left(t^o\right)Al_2O_3+3H_2O\\ \left(5\right)2Al_2O_3\rightarrow\left(t^o,criolit\right)4Al+3O_2\\ \left(6\right)2Al+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2\)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Cho sơ đồ biểu diễn chuyển đổi sau:
Phi kim (1)→ oxit axit(1) (2)→ oxit axit (2) (3)→ axit (4)→ muối sunfat tan → muối sunfat không tan
a, Tìm công thức các chất thích hợp để thay cho tên chất trong sơ đồ
b, Viết các phương trình hóa học biểu diễn chuyển đổi trên
PTHH:
S+O2\(\underrightarrow{t^o}\)SO2
2SO2+O2\(\xrightarrow[V_2O_5]{t^o,p}\)SO3
SO3+H2O-->H2SO4
H2SO4+2NaOH-->Na2SO4+2H2O
Na2SO4+BaCl2-->BaSO4\(\downarrow\)+2NaCl
Đúng 1
Bình luận (0)
hãy viết phương trình hóa học biểu diễn phản ứng hóa hợp của lưu huỳnh với các kim loại sau (biết trong hợp chất S có hóa trị 2) a.nhôm b.sắt c.chì d.natri
Xem chi tiết
\(2Al+3S\underrightarrow{t^0}Al_2S_3\)
\(Fe+S\underrightarrow{t^0}FeS\)
\(Pb+S\underrightarrow{t^0}PbS\)
\(2Na+S\underrightarrow{t^0}Na_2S\)
Đúng 1
Bình luận (1)
a) 2 Al + 3 S -to-> Al2S3
b) Fe + S -to-> FeS
c) Pb + S -to-> PbS
d) 2 Na + S -to-> Na2S
Đúng 1
Bình luận (0)
a. S + Al → Al2S3.
b. Fe + S → FeS.
c. Pb + S → PbS.
d. Na + S → Na2S.
(Tất cả các phản ứng trên đều có nhiệt độ nha.)
Đúng 0
Bình luận (0)
viết phương trình biểu diễn sự chuyển đổi hóa học sau: C2H4-C2H3OH-CH3OOH-CH3COOC2H5
Sửa đề: C2H3OH thành C2H5OH
\(C_2H_4+H_2O\overrightarrow{axit}C_2H_5OH\\ C_2H_5OH+O_2\underrightarrow{\text{men giấm}}CH_3COOH\\ C_2H_5OH+CH_3COOH\xrightarrow[H_2SO_4đặc]{t^o}CH_3COOC_2H_5+H_2O\)
Đúng 1
Bình luận (0)
Viết phương trình hóa học biểu diễn sự chuyển đổi sau đây ( ghi rõ điều kiện nếu có )
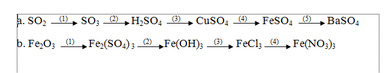
a.
\(1.2SO_2+O_2->2SO_3\)
\(2.H_2O+SO_3->H_2SO_4\)
\(3.CuO+H_2SO_4->CuSO_4+H_2O\)
\(4.Fe+CuSO_4->FeSO_4+Cu\)
\(5.FeSO_4+BaCl_2->BaSO_4+FeCl_2\)
Đúng 0
Bình luận (1)
a.
\(\left(1\right)2SO_2+O_2\xrightarrow[V_2O_5]{t^o}2SO_3\)
\(\left(2\right)SO_3+H_2O\xrightarrow[]{}H_2SO_4\)
\(\left(3\right)H_2SO_4+CuO\xrightarrow[]{}CuSO_4+H_2O\)
\(\left(4\right)Fe+CuSO_4\xrightarrow[]{}Cu\downarrow+FeSO_4\)
\(\left(5\right)FeSO_4+BaCl_2\xrightarrow[]{}BaSO_4\downarrow+FeCl_2\)
b.
\(\left(1\right)Fe_2O_3+3H_2SO_4\xrightarrow[]{}Fe_2\left(SO_4\right)_3+3H_2O\)
\(\left(2\right)Fe_2\left(SO_4\right)_3+6NaOH\xrightarrow[]{}2Fe\left(OH\right)_3+3Na_2SO_4\)
\(\left(3\right)Fe\left(OH\right)_3+3HCl\xrightarrow[]{}FeCl_3+3H_2O\)
\(\left(4\right)FeCl_3+3HNO_3\xrightarrow[]{}Fe\left(NO_3\right)_3+3HCl\)
Đúng 1
Bình luận (0)
b.
\(Fe_2O_3+3H_2SO_4->Fe_2\left(SO_4\right)_3+3H_2O\)
\(Fe_2\left(SO_4\right)_3+3NaOH->Fe\left(OH\right)_3+3Na_2SO_4\)
\(Fe\left(OH\right)_3+HCl->FeCl_3+H_2O\)
\(FeCl_3+3AgNO_3->Fe\left(NO_3\right)_3+3AgCl\)
Đúng 0
Bình luận (0)
1. Đại cương kim loạicâu 1: Trình bày vị trí cấu tạo của kim loạiCâu 2: Nêu tính chất vật lý chung của kim loại và tính chất vật lý riêng của kim loạiCâu 3: Trình bày tính chất hóa học của kim loại và viết phản ứng hóa học cho từng tính chất.Câu 4: Nêu khái niệm hợp kim và cho ví dụ (tính chất chung của hợp kim là gì?Câu 5: Trình bày nguyên tắc điều chế kim loại (3 phương pháp: Thủy luyện, nhiệt luyện và điện phân)2. Dãy điện hóaCâu 1: Trình bày pin điện gồm điện cực nào? Các tính suất điện động...
Đọc tiếp
1. Đại cương kim loại
câu 1: Trình bày vị trí cấu tạo của kim loại
Câu 2: Nêu tính chất vật lý chung của kim loại và tính chất vật lý riêng của kim loại
Câu 3: Trình bày tính chất hóa học của kim loại và viết phản ứng hóa học cho từng tính chất.
Câu 4: Nêu khái niệm hợp kim và cho ví dụ (tính chất chung của hợp kim là gì?
Câu 5: Trình bày nguyên tắc điều chế kim loại (3 phương pháp: Thủy luyện, nhiệt luyện và điện phân)
2. Dãy điện hóa
Câu 1: Trình bày pin điện gồm điện cực nào? Các tính suất điện động của pin
Câu 2: Viết biểu thức định luật Faraday và chú thích các đại lượng trong biểu thức
Câu 3: Thế nào là sự ăn mòn? Trình bày điểm giống và khác nhau giữa ăn mòn hóa học và ăn mòn điện hóa.
Phương trình hóa học dùng để:
A. biểu diễn sự biến đổi của các nguyên tử, B. biểu diễn sự biến đổi của từng chất riêng rẽ.
C. biểu diễn phản ứng hóa học bằng chữ. D. biểu diễn ngắn gọn phản ứng hóa học.
Viết phương trình hóa học biểu diễn những chuyển đổi hóa học sau:
![]()
(1) C + O 2 → t ° C O 2
(2) C O 2 + Ca OH 2 → CaC O 3 + H 2 O
(3) CaC O 3 → CaO + C O 2
(4) CaO + H 2 O → Ca OH 2
(5) Ca OH 2 + 2C O 2 → Ca HCO 3 2
Đúng 0
Bình luận (0)
Viết phương trình hóa học biểu diễn những chuyển đổi hóa học sau:
![]()
![]()
(1) Fe 2 O 3 + 3 H 2 → 2Fe + 3 H 2 O
(2) 2Fe + 3 Cl 2 → 2Fe Cl 3
(3) Fe Cl 3 + 3NaOH → 3NaCl + Fe OH 3
(4) 2Fe OH 3 → Fe 2 O 3 + 3 H 2 O
(5) Fe + HCl → Fe Cl 2 + H 2
(6) Fe Cl 2 + 2NaOH → Fe OH 2 + 2NaCl
Đúng 0
Bình luận (0)







