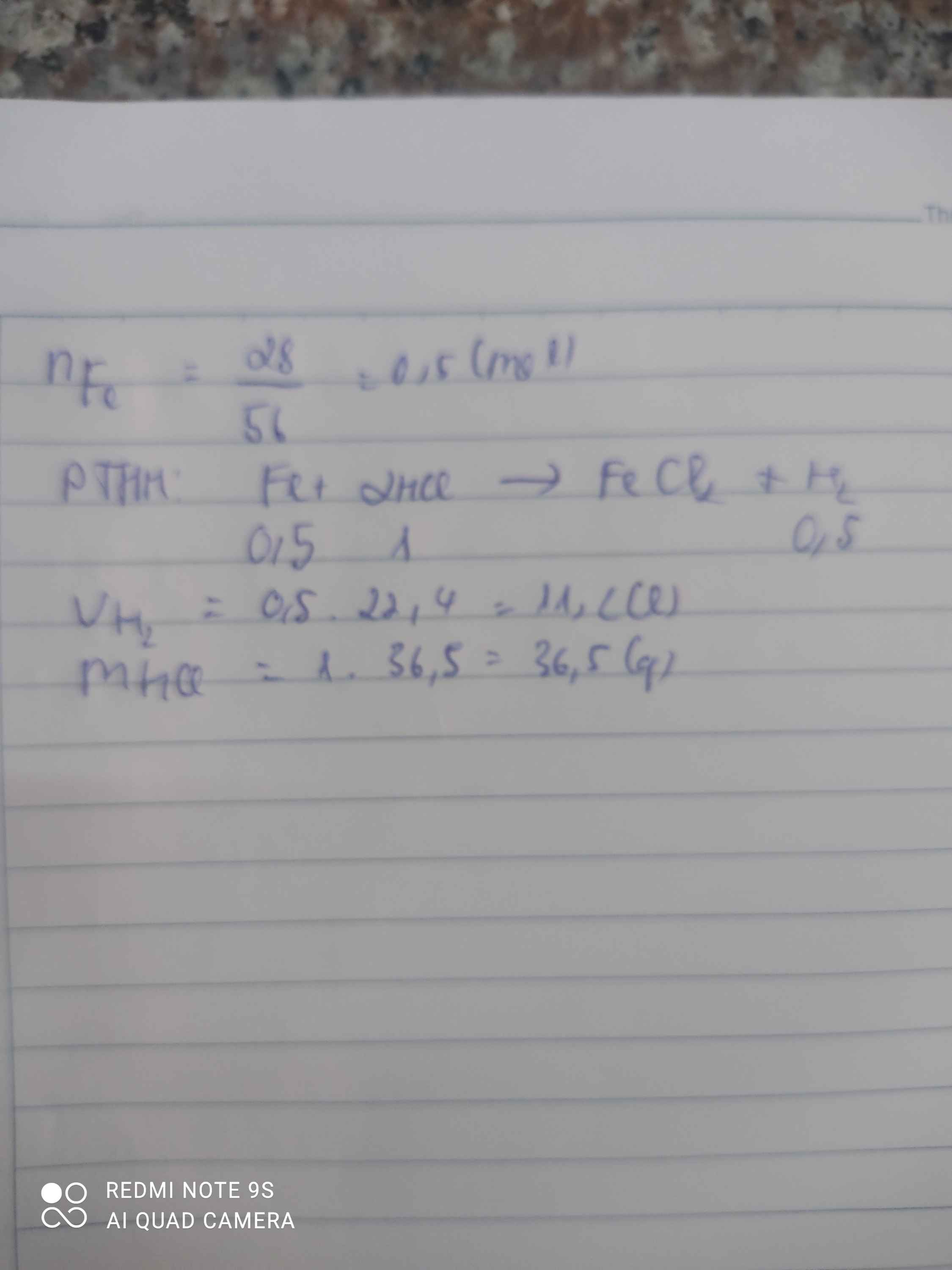Cho 23,2 gam Fe3O4 tác đụng với H2 Tính khối lượng sắt và thể tích H2 tham gia phản ứng
HV
Những câu hỏi liên quan
Câu 3 (2đ): Cho khí H2 dư tác dụng với Fe2O3 đun nóng, thu được 16,8 gam Fe a, Thể tích khí H2 (đktc) đã tham gia phản ứng là b, Tính khối lượng axit clohidric cần dùng để tác dụng hết với lượng sắt sinh ra ở phản ứng trên?
a) n Fe = 16,8/56 = 0,3(mol)
$Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O$
n H2 = 3/2 n Fe = 0,45(mol)
=> V H2 = 0,45.22,4 = 10,08(lít)
b)
$Fe + 2HCl \to FeCl_2 + H_2$
n HCl = 2n Fe = 0,6(mol)
=> m HCl = 0,6.36,5 = 21,9 gam
Đúng 3
Bình luận (0)
cho 28 gam sắt tác dụng với axit HCl (dư) sau phản ứng thu được (II) clorua (FeCl2) và khí hiđro
a viết phương trình phản ứng
b tính thể tích khí H2 thu được ở điều kiện tiêu chuẩn?
c tính khối lượng axit HCl đã tham gia phản ứng
\(n_{Fe}=\dfrac{28}{56}=0,5mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,5 1 0,5
\(V_{H_2}=0,5\cdot22,4=11,2l\)
\(m_{HCl}=1\cdot36,5=36,5g\)
Đúng 4
Bình luận (0)
Cho a gam hỗn hợp CuO và Fe,O, tác dụng với H2 ở nhiệt độ thích hợp. Sau khi phản ứng xảy ra hoàn toàn thu được 23,2 gam hỗn hợp hai kim loại trong đó sắt nhiều hơn đồng 10,4 gam. Hãy tính khối lượng a đem phản ứng và thể tích khí hiđro (ở đktc) cần dùng cho 2 phản ứng trên.
Đốt cháy 16,8 gam Sắt, sau phản ứng ta thu được 23,2 gam sắt từ oxit ( Fe3O4 ).
a. Tính khối lượng oxi đã tham gia phản ứng.
b. Tìm thành % về khối lượng các nguyên tố trong hợp chất sắt từ oxit ( Fe3O4 ).
Kẽm tác dụng với axit clohidric, cho 6,5 gam Zn tham gia phản ứng hãy tính thể tích của h2 và khối lượng axit clohidric cần dùng
Xem chi tiết
\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
1 mol _ 2 mol _ 1 mol _ 1 mol
0,1 mol _ 0,2 mol _ 0,1 mol _ 0,1 mol
\(n_{H_2}=\dfrac{n_{Zn}.1}{1}=0,1\left(mol\right)\)
\(V_{H_2}=n_{H_2}.22,4=0,1.22,4=2,24\left(l\right)\)
\(n_{HCl}=\dfrac{n_{Zn}.2}{1}=0,2\left(mol\right)\)
\(m_{HCl}=n_{HCl}.M_{HCl}=0,2.36,5=7,3\left(g\right)\)
Đúng 2
Bình luận (0)
Cho sơ đồ của phản ứng sau : Fe+ O2 ----> Fe3O4 a, lập PTHH của phản ứng trên b, tính khối lượng oxi tham gia PƯ biết 16,8 gam sắt phản ứng thì thu được 23,2 gam oxit sắt từ
\(a,PTHH:3Fe+2O_2\xrightarrow{t^o}Fe_3O_4\\ b,BTKL:m_{Fe}+m_{O_2}=m_{Fe_3O_4}\\ \Rightarrow m_{O_2}=23,2-16,8=6,4(g)\)
Đúng 3
Bình luận (0)
cho 11,2g bột sắt tác dụng hết với dd HCl 1M , sau phản ứng thu được 3,36 lít khí H2 ( đktc) : a ) tính thể tích khí H2 thoát ra ở đktc . B) tính khối lượng dung dịch HCl đã tham gia phản ứng
a,\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right);n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,15 0,3
Ta có: \(\dfrac{0,2}{1}>\dfrac{0,15}{1}\) ⇒ H2 pứ hết,Fe dư
\(V_{H_2}=3,36\left(l\right)\) (đề cho)
b, ko tính đc k/lg dd ,chỉ tính đc thể tích dd
\(V_{ddHCl}=\dfrac{0,2}{1}=0,2\left(l\right)=200\left(ml\right)\)
Đúng 0
Bình luận (0)
. Áp dụng định luật bảo toàn khối lượng tính khối lượng các chất trong từng phản ứng dưới đây:
a/ Đốt cháy 16,8 gam sắt trong bình đựng oxi thu được 23,2 gam oxit sắt từ Fe3O4. Tính khối lượng oxi đã tham gia phản ứng.
\(a,BTKL:m_{Fe}+m_{O_2}=m_{Fe_3O_4}\\ \Rightarrow m_{O_2}=m_{Fe_3O_4}-m_{Fe}=23,2-16,8=6,4(g)\)
Đúng 2
Bình luận (0)
sắt tác dụng với axit clohidric HCL theo sơ đồ phản ứng sau fe + HCL ---> FeCl2 +H2
nếu có 11,2 gam sắt tham gia phản ứng Hãy tính
a. khối lượng axit chohidric HCL cần dùng
b. thể tích khí hidro tạo thành ở đktc
( cho biết Fe = 56 ; Zn = 65 ; S=32; O = 16 ; K= 39; H=1 ; C=12; CL=35)
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
_____0,2_____0,4__________0,2 (mol)
a, \(m_{HCl}=0,4.36,5=14,6\left(g\right)\)
b, \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
Đúng 1
Bình luận (0)
Cho một đinh sắt nặng 8,4 gam tác dụng với dung dịch HCl dư. Sau phản ứng xong cân lại thấy khối lượng dung dịch nặng thêm 8,1 gam.
a. Viết PTHH xảy ra.
b. Tính thể tích H2 sinh ra ở(đktc).
c. Tính số mol HCl đã tham gia phản ứng
a) Fe + 2HCl --> FeCl2 + H2
b) mtăng = mFe - mH2
=> mH2 = 8,4 - 8,1 = 0,3 (mol)
=> \(n_{H_2}=\dfrac{0,3}{2}=0,15\left(mol\right)\)
=> VH2 = 0,15.22,4 = 3,36 (l)
c) nHCl(pư) = 0,3 (mol)
Đúng 4
Bình luận (0)