4/ cho Na vào nước để tạo 200g dd NaOH 20% .Hãy tính khối lượng của Na và thể tích khí H2 thoát ra.
H24
Những câu hỏi liên quan
Cho a (g) Na vào nước thu được 200g dd NaOH 10% và khí H2. Tính khối lượng Na cần dùng và thể tích khí H2 thoát ra (ở đktc
\(m_{NaOH}=200.10\%=20\left(g\right)\Rightarrow n_{NaOH}=\dfrac{20}{40}=0,5\left(mol\right)\)
PTHH: 2Na + 2H2O → 2NaOH + H2
Mol: 0,5 0,5 0,5
\(m_{Na}=0,5.23=11,5\left(g\right)\)
\(V_{H_2}=0,25.22,4=5,6\left(l\right)\)
Đúng 1
Bình luận (0)
Cho 9,2g Na vào nước dư thì thu được dung dịch NaOH và khí H2.Tính thể tích khí H2(đktc) thoát ra và khối lượng NaOH tạo thành?
\(n_{Na}=\dfrac{9,2}{23}=0,4\left(mol\right)\)
\(pthh:2Na+2H_2O->2NaOH+H_2\)
0,4 0,4 0,2
=> \(V_{H_2}=0,2.22,4=4,48\left(L\right)\\ m_{NaOH}=0,4.40=16\left(G\right)\)
Đúng 3
Bình luận (1)
nNa=9,2/23=0,4(mol)
2Na + 2H2O --> 2NaOH + H2
0,4 0,4 0,4 0,2
VH2=0,2.22,4=4,48(l)
mNaOH=0,4x40=16(g)
refer
`nNa = 9,2:23=0,4(mol)`
`2Na + 2H_2O -> 2NaOH + H_2↑`
`=> nH_2=1/2 . nNa=0,2(mol)`
`=> VH_2 =0,2.22,4=4,48(l)`
`=> nNaOH = nNa = 0,4(mol)`
`=> mNaOH =0,4.40=16(g)`
Cho 9,2g Na vào 100g nước thì thu được dung dịch NaOH và khí H2 a, Tính thể tích khí H2(đktc) thoát ra và khối lượng NaOH tạo thành? b, Tính nồng độ phần trăm của dụng dịch NaOH?
nNa = 9.2/23 = 0.4 (mol)
2Na + 2H2O => 2NaOH + H2
0.4.........................0.4.......0.2
VH2 = 0.2 * 22.4 = 4.48 (l)
mNaOH = 0.4 * 40 = 16 (g)
mdd = 9.2 + 100 - 0.2 * 2 = 108.8 (g)
C% NaOH = 16 / 108.8 * 100% = 14.71%
Đúng 3
Bình luận (0)
PTHH: \(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\uparrow\)
Ta có: \(n_{Na}=\dfrac{9,2}{23}=0,4\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{NaOH}=0,4\left(mol\right)\\n_{H_2}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{NaOH}=0,4\cdot40=16\left(g\right)\\V_{H_2}=0,2\cdot22,4=4,48\left(l\right)\\m_{H_2}=0,2\cdot2=0,4\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd\left(saup/ứ\right)}=m_{Na}+m_{H_2O}-m_{H_2}=108,8\left(g\right)\)
\(\Rightarrow C\%_{NaOH}=\dfrac{16}{108,8}\cdot100\%\approx14,71\%\)
Đúng 2
Bình luận (0)
nNa=9,2/23=0,4(mol).
PTPƯ: 2Na (0,4) + 2 H2O(0,4)----> 2NaOH (0,4)+ H2(0,2).
a)VH2= 0,2.22,4=4,48(lít).
mNaOH= 0,4.40=16(g).
b)mH2=0,2.2=0,4(mol).
mdd(sau pư)=mNa+mH2O-mH2=9,2+100-0,4=108,8(g)
C%ddNaOH=16/108,8.100=14,705%.
Đúng 1
Bình luận (0)
Cho 9,2g Na vào nước dư thì thu được dung dịch NaOH và khí H2. a. Viết phương trình hoá học b. Tính thể tích khí H2 (đktc) thoát ra và khối lượng NaOH tạo thành ? c. Nếu dùng toàn bộ lượng H2 bay ra ở trên đem khử 12 gam bột CuO ở nhiệt độ cao thì chất nào còn dư bao nhiêu gam ? ( Zn 65 ; Cl 35,5 ; Cu 64 ; O 16 ; H 1 )
Đọc tiếp
Cho 9,2g Na vào nước dư thì thu được dung dịch NaOH và khí H2.
a. Viết phương trình hoá học
b. Tính thể tích khí H2 (đktc) thoát ra và khối lượng NaOH tạo thành ?
c. Nếu dùng toàn bộ lượng H2 bay ra ở trên đem khử 12 gam bột CuO ở nhiệt độ cao thì chất nào còn dư bao nhiêu gam ? ( Zn = 65 ; Cl = 35,5 ; Cu = 64 ; O = 16 ; H= 1 )
\(a.2Na+2H_2O\rightarrow2NaOH+H_2\\ b.n_{Na}=\dfrac{9,2}{23}=0,4\left(mol\right)\\ n_{H_2}=\dfrac{1}{2}n_{Na}=0,2\left(mol\right)\\ \Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\\ n_{NaOH}=n_{Na}=0,4\left(mol\right)\\ \Rightarrow m_{NaOH}=0,4.40=16\left(g\right)\\ c.H_2+CuO-^{t^o}\rightarrow Cu+H_2O\\ n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\\ LTL:\dfrac{0,2}{1}>\dfrac{0,15}{1}\Rightarrow H_2dưsauphảnứng\\ n_{H_2\left(pứ\right)}=n_{CuO}=0,15\left(mol\right)\\ \Rightarrow n_{H_2\left(dư\right)}=0,2-0,15=0,05\left(mol\right)\\ \Rightarrow m_{H_2\left(Dư\right)}=0,05.2=0,1\left(g\right)\)
Đúng 1
Bình luận (0)
Hòa tan 0,46g Na vào 200g H2O, thu được dd NaOH và H2 a.Tìm thể tích khí H2 ở đức b.tìm kl chất tan NAOH c.Tìm kl dd NaOH tạo ra d.tìm C% của dd NaOH
\(n_{Na}=0.02\left(mol\right)\)
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
\(0.02....................0.02........0.01\)
\(V_{H_2}=0.01\cdot22.4=0.224\left(l\right)\)
\(m_{NaOH}=0.02\cdot40=0.8\left(g\right)\)
\(C\%_{NaOH}=\dfrac{0.8}{0.46+200-0.01\cdot2}\cdot100\%=0.4\%\)
Đúng 1
Bình luận (0)
Bài 1: Cho 4,6 gam Na phản ứng với 1,8 gam nước tạo ra NaOh và khí H2. Sau phản ứng chất nào dư và dư với khối lượng bao nhiêu? Tính thể tích H2 thoát ra ở (đktc)
\(2Na+2H_2O\rightarrow2NaOH+H_2\\ n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\\ n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\\ LTL:\dfrac{0,2}{2}>\dfrac{0,1}{2}\\ \Rightarrow Nadư\\ n_{Na\left(pứ\right)}=n_{H_2O}=0,1\left(mol\right)\\ n_{Na\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\\ \Rightarrow m_{Na}=0,1.23=2,3\left(g\right)\\ n_{H_2}=\dfrac{1}{2}n_{H_2O}=0,05\left(mol\right)\\ \Rightarrow V_{H_2}=0,05.22,4=1,12\left(l\right)\)
Đúng 2
Bình luận (0)
Hỗn hợp X gồm Na và Al. Cho m gam X vào một lượng dư nước thì thoát ra V lít khí. Nếu cũng cho m gam X vào dd NaOH (dư) thì được 1,75V lít khí. Thành phần phần trăm theo khối lượng của Na trong X là (biết các thể tích khí đo trong cùng điều kiện) A. 39,87% B. 29,87% C. 49,87% D. 77,31%
Đọc tiếp
Hỗn hợp X gồm Na và Al. Cho m gam X vào một lượng dư nước thì thoát ra V lít khí. Nếu cũng cho m gam X vào dd NaOH (dư) thì được 1,75V lít khí. Thành phần phần trăm theo khối lượng của Na trong X là (biết các thể tích khí đo trong cùng điều kiện)
A. 39,87%
B. 29,87%
C. 49,87%
D. 77,31%
Ta thấy 1,75 lít > 1 lít
Chứng tỏ phần tác dụng với nước thì n Na = n NaOH không tác dụng hết n Al, còn phần sau là mới tác dụng hết
Na + H2O --> NaOH + 1/2.H2
x ---- ------ --------> x -----> x/2
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
x <-----x ------------ ------- ------- ------- -> 3x/2
=> x/2 + 3x/2 = 1 <=> x = 0.5
Ta tính số mol do Al sinh ra là = 1.75 - 0.5/2 = 1,5 mol
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
1 <---------- --------- ---------- ----------- 1,5 mol
% m Al = ( 1.27 ) / (1.27 + 0.5.23 ) x 100% = 70,13%
=> %Na = 29,87%
=> Đáp án B
Đúng 1
Bình luận (0)
Hh X gồm Na và A1. Cho m gam X vào một lượng dư nước thì thoát ra V lít khí. Nếu cũng cho m gam X vào dd NaOH (dư) thì được 1 ,75V lít khí. Thành phần phần trăm theo khối lượng của Na trong X 1à (biết các thể tích khí đo trong cùng điều kiện, cho Na: 23, A1: 27) A. 39, 87% B. 73,1% C. 49, 87% D. 29,87%
Đọc tiếp
Hh X gồm Na và A1. Cho m gam X vào một lượng dư nước thì thoát ra V lít khí. Nếu cũng cho m gam X vào dd NaOH (dư) thì được 1 ,75V lít khí. Thành phần phần trăm theo khối lượng của Na trong X 1à (biết các thể tích khí đo trong cùng điều kiện, cho Na: 23, A1: 27)
A. 39, 87%
B. 73,1%
C. 49, 87%
D. 29,87%
Đáp án D
Do các khí đo ở cùng điều kiện nên ta “có thể” coi V như số mol để tính cho đơn giản.
TH1:
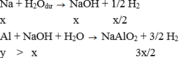
TH2:
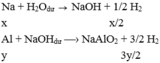
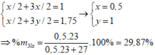
Đúng 1
Bình luận (0)
bài 1:Cho 6,5g Zn tác dụng vừa đủ với 200g dd HCl tạo thành dd ZnCl2 và khí H2.a/Tính khối lượng HCl đã phản ứng?b/ Tính thể tích khí H2 thoát ra(đktc)?c/Tính khối lượng dd sau phản ứng?Bài 2:Cho 4,8g Mg tác dụng vừa đủ với 100g dd HCl tạo thành dd MgCl2 và khí H2.a/Tính khối lượng HCl đã phản ứng?b/Tính thể tích khí H2 thoát ra(đktc)?c/Tính nồng độ phần trăm của dd sau phản ứng?MỌI NGƯỜI ƠI GIÚP VỚI Ạ!!! làm ơn SOS
Đọc tiếp
bài 1:Cho 6,5g Zn tác dụng vừa đủ với 200g dd HCl tạo thành dd ZnCl2 và khí H2.
a/Tính khối lượng HCl đã phản ứng?
b/ Tính thể tích khí H2 thoát ra(đktc)?
c/Tính khối lượng dd sau phản ứng?
Bài 2:Cho 4,8g Mg tác dụng vừa đủ với 100g dd HCl tạo thành dd MgCl2 và khí H2.
a/Tính khối lượng HCl đã phản ứng?
b/Tính thể tích khí H2 thoát ra(đktc)?
c/Tính nồng độ phần trăm của dd sau phản ứng?
MỌI NGƯỜI ƠI GIÚP VỚI Ạ!!! làm ơn SOS
\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 0,1
\(m_{HCl}=0,2.36,5=7,3\left(g\right)\\
V_{H_2}=0,1.22,4=2,24l\\
m_{\text{dd}}=6,5+200-\left(0,1.2\right)=206,3g\)
bài 2 :
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\
pthh:Mg+2HCl\rightarrow MgCl_2+H_2\)
0,2 0,4 0,2 0,2
\(m_{HCl}=0,4.36,5=14,6g\\
V_{H_2}=0,2.22,4=4,48l\\
m\text{dd}=4,8+200-0,4=204,4g\\
C\%=\dfrac{0,2.136}{204,4}.100\%=13,3\%\)
Đúng 2
Bình luận (0)







