Hoà tan 8,1g hỗn hợp Zn & ZnS bằng 250g dung dịch HCl 7,3% thu được dung dịch Y và 2,24 dm3 hỗn hợp X gồm 2 khí ở đktc.
a,Tính số gam mỗi chất trong hỗn hợp ban đầu và C% các chấtt trong dung dịch Y
b. Tính dX/H2
Hoà tan hỗn hợp X gồm 37,2 gam Zn và Fe trong 1 mol H2SO4
a. Chứng minh hỗn hợp X tan hết.
b. Nếu hoà tan với lượng gấp đôi hỗn hợp X cùng lượng axit trên thì hỗn hợp có tan hết không?
A, a.tan hết, b.không tan hết
B, a.tan hết, b. tan hết
C, a. không tan hết, b.không tan hết
D, a.không tan hết, b. tan hết
a. Có các phản ứng hóa học xảy ra:
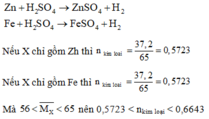
Ta có: n H 2 S O 4 phản ứng = nkim loại < 0,6643
Mà: n H 2 S O 4 ban đầu = 1 > 0,6643 nên sau phản ứng kim loại tan hết, axit còn dư.
b. Khi sử dụng lượng X gấp đôi thì 0,5723.2 < nkim loại < 0,6643.2
Hay 1,1446 < nkim loại < 1,3286
Mà nếu các kim loại bị hòa tan hết thì n H 2 S O 4 phản ứng = nkim loại > 1,1446
Do n H 2 S O 4 thực tế = 1 < 1,1446 nên sau phản ứng kim loại chưa tan hết.
Đán án A
Để hoà tan 10,7g hỗn hợp Zn và ZnO cần 100g dung dịch HCl 10,22%. Xác định thành phần hỗn hợp.
hoà tan 17,7g hỗn hợp bột kim Zn và Fe càn 300ml đ H2SO4 1M. Khối lượng của Fe trong hỗn hợp là bao nhiêu gam
Hoà tan 12,1 g hỗn hợp bột kim loại Zn và Fe cần 400ml dung dịch HCl 1M. Khối lượng hỗn hợp muối thu được sau phản ứng là:
A. 26,3 g
B. 40,5 g
C. 19,2 g
D. 22,8 g
Chọn A

gọi x, y lần lượt là số mol của kẽm và sắt
ta có
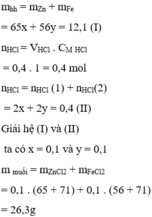
Để hoà tan hết hỗn hợp Zn và ZnO phải dùng 100,8 ml dung dịch HCl 36,5% ( D = 1,19 g/ml ) thu được 0,4 mol khí. Thành phần % về khối lượng hỗn hợp Zn và ZnO ban đầu lần lượt là :
A. 61,6% và 38,4%
B. 50,0% và 50,0%
C. 45,0% và 55,0%
D. 40,0% và 60,0%
Đáp án A
![]() .100 => mHCl = 43,78 (g)
.100 => mHCl = 43,78 (g)
nHCl = 1,2 (mol)
Gọi nZn = a, nZnO = b
Zn + 2HCl → ZnCl2 + H2
0,4 0,8 ← 0,4 (mol)
ZnO + 2HCl → ZnCl2 + H2O
0,2 ← 0,4 (mol)
![]() .100%
.100%
![]() .100% = 61,61%
.100% = 61,61%
%mZnO = 100% -61,6% = 38,4%
Hoà tan hoàn toàn 24,9 gam hỗn hợp kim loại gồm Al và Zn trong HNO3 loãng thu được 3,36 lít khí N2O duy nhất(đktc). Xác định % khối lượng của Al, Zn trong hỗn hợp kim loại
Mình cần bài làm đầy đủ ạ :((
\(n_{N_2O}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Gọi số mol Al, Zn là a, b
=> 27a + 65b = 24,9
PTHH: 8Al + 30HNO3 --> 8Al(NO3)3 + 3N2O + 15H2O
______a------------------------------>0,375a
4Zn + 10HNO3 --> 4Zn(NO3)2 + N2O + 5H2O
b-------------------------------->0,25b
=> 0,375a + 0,25b = 0,15
=> a = 0,2 ; b = 0,3
=> \(\left\{{}\begin{matrix}\%Al=\dfrac{0,2.27}{24,9}.100\%=21,69\%\\\%Zn=\dfrac{0,3.65}{24,9}.100\%=78,31\%\end{matrix}\right.\)
Câu 17: Cho 8,9g hỗn hợp Zn, Mg tan hoàn toàn trong H2SO4 đặc nóng thu được dung dịch X và 0,15 mol SO2 ; 0,01 mol S ; 0,005 mol H2S. Tính khối lượng của mỗi kim loại trong hỗn hợp?
2 2. Hoà tan 37,1 g hh X gồm Fe, Zn, Cu trong dd H2SO4 đđ, nóng dư thu được dung dịch A và 15,68 lít khí SO2 (sản phẩm khử duy nhất). 37,1 g X tác dụng với dd HCl dư thì thu được 11,2 lít khí (đkc). Tính % khối lượng mỗi kim loại trong hh X.
Câu 23. Cho 7,6 gr hỗn hợp gồm Fe, Mg, Cu vào dung dịch H2SO4 đ, nguội dư thì thu được 3,08 lit khí SO2 (đkc). Phần không tan cho tác dụng với dung dịch HCl dư thu được 1,12 lit khí (đkc).Tính % khối lượng hỗn hợp đầu
Cho hỗn hợp Z gồm Zn và Fe có khối lượng 18,6g . Hoà tan hỗn hợp này trong 500ml dd \(H_2SO_4\) 1M
a) Chứng minh hỗn hợp này tan hết
b) Tính khối lượng mỗi kim loại biết lượng \(H_2\) sinh ra trong phản ứng này tác dụng vừa đủ với 24g CuO
Để hoà tan hoàn toàn hỗn hợp gồm hai kim loại Cu và Zn, ta có thể dùng một lượng dư dung dịch
A. CuSO4
B. AlCl3
C. HCl
D. FeCl3.