Đốt cháy hoàn toàn 2,2g hidrocacbon A thu được 3,6g nước. Tính công thức phân tử A, biết khổi l;ượng mol của A là 44g/mol
NM
Những câu hỏi liên quan
Đốt cháy hoàn toàn 2,2g hợp chất hữu cơ A thu được 6,6g CO2 và 3,6g H2O. Biết A có tỉ khối so với khí H2 là 22. Xác định công thức phân tử của hợp chất hữu cơ.
\(n_{CO_2}=\dfrac{6,6}{44}=0,15\left(mol\right)\)
\(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(mol\right)\)
Bảo toán C: nC(A) = 0,15 (mol)
Bảo toàn H: nH(A) = 0,2.2 = 0,4 (mol)
=> \(n_O=\dfrac{2,2-0,15.12-0,4.1}{16}=0\left(mol\right)\)
Xét nC : nH = 0,15 : 0,4 = 3:8
=> CTPT: (C3H8)n
Mà MA = 22.2 = 44(g/mol)
=> n = 1
=> CTPT: C3H8
Đúng 4
Bình luận (0)
Đốt cháy hoàn toàn 3,2 gam hidrocacbon A trong không khí thu được 8,8 gam \(CO_2\) và hơi nước. Tìm công thức phân tử của A, biết tỉ khối của A so với khí oxi bằng 0,5.
Gọi CTHH là \(C_xH_y\)
\(n_{CO_2}=\dfrac{8,8}{44}=0,2mol\Rightarrow m_C=2,4g\)
\(d_A\)/O2=0,5\(\Rightarrow M_A=0,5\cdot32=16đvC\)
\(n_A=\dfrac{3,2}{16}=0,2mol\)
\(\overline{C}=\dfrac{n_{CO_2}}{n_A}=\dfrac{0,2}{0,2}=1\)
Vậy A là \(CH_4\).
Đúng 2
Bình luận (1)
Đốt cháy hoàn toàn một hidrocacbon A thì thu được 4,4 gam khi cacbon dioxit và 2,7 gam nước. Biết khối lượng mol của A là 30 gam. Hãy xác định công thức phân tử của A.
\(n_{CO_2}=\dfrac{4,4}{44}=0,1\left(mol\right)\); \(n_{H_2o}=\dfrac{2,7}{18}=0,15\left(mol\right)\)
Bảo toàn C: nC(A) = 0,1 (mol)
Bảo toàn H: nH(A) = 0,3 (mol)
Xét nC : nH = 0,1 : 0,3 = 1 : 3
=> A có dạng (CH3)n
Mà MA = 30 (g/mol)
=> n = 2
=> A là C2H6
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 1,15g hợp chất hữu cơ X, thu được 2,2g khí CO2 và 1,35g nước . Biết tỉ khối hơi của X so với khí oxi lá 1,4375 . Xác định công thức phân tử của X
\(n_C=\dfrac{2,2}{44}=0,05\left(mol\right)\\ n_H=2.\dfrac{1,35}{18}=0,15\left(mol\right)\\ n_O=\dfrac{1,15-0,05.12-0,15}{16}=0,025\left(mol\right)\)
\(CTPT:C_xH_yO_z\\ \Rightarrow x:y:z=0,05:0,15:0,025=2:6:1\\ \Rightarrow\left(C_2H_6O\right)_n=1,4375.32=46\left(\dfrac{g}{mol}\right)\\ \Rightarrow n=1\\ CTPT:C_2H_6O\)
Đúng 3
Bình luận (0)
Đốt cháy hoàn toàn a lit khí hidrocacbon
C
x
H
y
, thu được 6,72 lit khí
C
O
2
và 7,2g
H
2
O
. Tìm công thức phân tử hidrocacbon, biết hidrocacbon này có tỉ khối so với heli bằg 11, các khí được đo ở đktc.
Đọc tiếp
Đốt cháy hoàn toàn a lit khí hidrocacbon C x H y , thu được 6,72 lit khí C O 2 và 7,2g H 2 O . Tìm công thức phân tử hidrocacbon, biết hidrocacbon này có tỉ khối so với heli bằg 11, các khí được đo ở đktc.
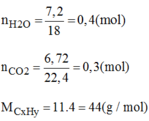
Phương trình hóa học của phản ứng:
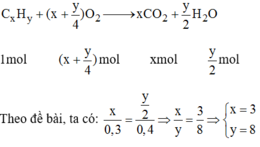
Công thức phân tử của H.C có dạng C 3 H 8 n
→ (12.3 + 1.8).n= 44 → n=1
Vậy công thức phân tử là C 3 H 8
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 4,2g Hidrocacbon A thu được 6,72 lít khí CO2 (đktc) và hơi nước. Biết A có tỉ khối Hidro là 21. Xác định công thức phân tử của Hidrocacbon.
Giúp em với ạ :<
Em cảm ơn nhiều :3
Đặt công thức phân tử A là CxHy ( x,y ∈ N*)
nCO2 = 3.13,2/11=3,6(g)
mH = 12x/3,6=y/0,6=42/4,2
=> x=3 , y = 6
=> CTPT : C3H6
\(n_C=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ n_H=\dfrac{4,2-0,3.12}{1}=0,6\left(mol\right)\)
\(CTPT:C_xH_y\\ \rightarrow x:y=0,3:0,6=1:2\\ \rightarrow\left(CH_2\right)_n=21.2=42\\ \rightarrow n=2\\ CTPT:C_3H_6\)
Đúng 3
Bình luận (0)
đặt CTPT của hydrocacbon A là CxHy với (x,y ≠0)
MA =21.2= 42
⇒nA = 4,2/42 = 0,1 (mol)
nCO2 = 6,72/22,4=0,3 (mol)
PT : 2CxHy + (2x - y/2) O2 → 2xCO2 + yH2O
TPT: nCO2 = xnCxHy = 0,1x (mol)
hay 0,3=0,1.x
⇒x = 3
ta có: mA = (12x + y)0,1 = 4,2(g)
hay 12.3 + y =4,2
⇒y = 6
vậy CTPT của hydrocacbon A là C3H6.
Đúng 2
Bình luận (0)
đốt cháy hoàn toàn 1 hidrocacbon x thu được 2,688 lit co2 (đktc) và 4,32 gam nước. công thức phân tử của x là
\(n_{CO_2} = \dfrac{2,688}{22,4} = 0,12 < n_{H_2O} = \dfrac{4,32}{18} = 0,24(mol)\)
Do đó, X là hidrocacbon no.(CnH2n+2)
Ta có:
\(n_X = n_{H_2O} - n_{CO_2} = 0,24 - 0,12 = 0,12(mol)\\ \Rightarrow n = \dfrac{n_{CO_2}}{n_X} = \dfrac{0,12}{0,12} = 1\)
Vậy ,X là CH4
Đúng 2
Bình luận (0)
đốt cháy hoàn toàn hidrocacbon x thu được số mol co2 bằng 1 nửa số mol nước. x có công thức phân tử là
Coi \( n_{CO_2} = 1(mol) \Rightarrow n_{H_2O} = 1.2=2(mol)\)
X : CnH2n+2
Ta có : \(n_X = n_{H_2O} - n_{CO_2} = 2 -1 = 1(mol)\\ \Rightarrow n = \dfrac{n_{CO_2}}{n_X} = \dfrac{1}{1} =1\)
Vậy X là CH4
Đúng 3
Bình luận (0)
Đốt cháy hoàn toàn một hidrocacbon A thì thu được 4,4 gam khí cacbon đioxit và 2,7 gam nước. Biết khối lượng mol của A là 30 gam. Hãy xác định công thức phân tử của Agiúp mình với mình đâng cần gấp
Đọc tiếp
Đốt cháy hoàn toàn một hidrocacbon A thì thu được 4,4 gam khí cacbon đioxit và 2,7 gam nước. Biết khối lượng mol của A là 30 gam. Hãy xác định công thức phân tử của A
giúp mình với mình đâng cần gấp



