hòa tan 6g kim loại m vào hcl dư sau phản ứng kết thúc thấy dung dịch tăng 5,5g. m là kim loại nào
N2
Những câu hỏi liên quan
Hòa tan 6 gam kim loại M vào dd hcm dư , sau khi phản ứng kết thúc thấy dd tăng 5,5 gam . Vậy M là kim loại nào
mtăng = mM - mH2 = 5.5 (g)
=> mH2 = 6 - 5.5 = 0.5 (g)
nH2 = 0.5/2 = 0.25 (mol)
2M + 2nHCl => 2MCln + nH2
0.5/n.................................0.25
MM = 6/0.5/n = 12n
BL :
n = 2 => M = 24
M là : Mg
Đúng 3
Bình luận (0)
Cho kim loại M có hóa trị (II). Hòa tan hết 8 gam oxit của M vào dung dịch axit clohiđric. Sau khi kết thúc phản ứng thấy có 0,4 mol HCl đã phản ứng. Kim loại M là ?
Em cần gấp ạ.
`MO + 2HCl -> MCl_2 + H_2O`
Theo PT: `n_(MO) = (n_(HCl))/2`
`<=> 8/(M_M +16) = (0,4)/2`
`<=> M_M = 24`
`=>M` là `Mg`.
Đúng 2
Bình luận (0)
\(MO+2HCl\rightarrow MCl_2+H_2O\)
Ta có : \(n_{MO}=\dfrac{1}{2}n_{HCl}=0,2\left(mol\right)\)
=> \(M_{MO}=\dfrac{8}{0,2}=40\)
=> M=24 (Mg)
Đúng 3
Bình luận (0)
. Hòa tan hoàn toàn 16,25 gam kim loại M (chưa rõ hóa trị) vào dung dịch axit HCl dư. Khi phản ứng kết thúc thu được 5,6 lít H2 (đktc).
a. Xác định kim loại M trong số các kim loại cho sau: Na=23; Cu=64; Zn=65.
b. Tính thể tích dung dịch HCl 0,2M cần dùng để hòa tan hết lượng kim loại này.
a) \(2M+2nHCl\rightarrow2MCl_n+nH_2\)
\(n_M=\dfrac{2}{n}n_{H_2}=\dfrac{0,5}{n}\left(mol\right)\)
Ta có : \(M_M=\dfrac{16,25}{\dfrac{0,5}{n}}=32,5n\)
Chạy nghiệm n
n=1 => M=32,5 (loại)
n=2 => M=65 ( chọn)
n=3 => M=97,5 (loại)
Vậy M là Zn
b) Ta có : \(n_{HCl}=2n_{H_2}=0,5\left(mol\right)\)
=> \(V_{HCl}=\dfrac{0,5}{0,2}=2,5\left(lít\right)\)
Đúng 2
Bình luận (0)
lX là hỗn hợp của 2 kim loại kiềm thuộc hai chu kì liên tiếp trong bảng HTTH. Cho 6,2g X tan hết trong H2O sau khi phản ứng kết thúc thì thấy khối lượng dung dịch tăng 6g. Xác định 2 kim loại và tính m, %m mỗi kim loại trong X
Hòa tan 12,9 gam hỗn hợp 2 kim loại đều có hóa trị II vào dung dịch H2SO4 loãng dư , sau khi phản ứng kết thúc hoàn toàn , còn lại 6,4 gam kim loại không tan , lọc hết kim loại không tan ra thấy khối lượng tăng 6,3 g . Đem đốt cháy phần kim loại không tan trong không khí đến khối lượng không đổi thu được 8 gam một oxit duy nhất . Xác định 2 kim loại trên
Cho 11,7 gam một kim loại X hóa trị II vào 350 ml dung dịch HCl 1M, khi phản ứng kết thúc ta thấy kim loại vẫn còn dư. Mặt khác để hòa tan hoàn toàn lượng kim loại trên phải cần chưa đến 200 ml dung dịch HCl 2M. Tìm X.
nHCl = 0,35 . 1 = 0,35 (mol)
\(X+2HCl\rightarrow XCl_2+H_2\)
0,175 0,35 0,175 0,175 (mol)
nHCl (pứ 2 ) = 0,2 . 2 = 0,4 (mol)
\(X+2HCl\rightarrow XCl_2+H_2\)
0,2 0,4
\(nX=0,175+0,2=0,375\left(mol\right)\)
=> \(MX=\dfrac{11,7}{0,375}=\) 31,2 .-. k ra là s
Đúng 3
Bình luận (0)
Hòa tan 4.35 gam hỗn hợp hai kim loại gồm Mg và Al vào đ Hcl. Sau khi phản ứng kết thúc thấy khối lượng dung dịch tăng 3.95g. Tính thành phần phần trăm theo khối lượng mỗi kim loại có trong hỗn hợp
Xem chi tiết
\(n_{H_2} = \dfrac{4,35-3,95}{2} = 0,2(mol)\\ Mg + 2HCl \to MgCl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\)
\(\left\{{}\begin{matrix}Mg:x\left(mol\right)\\Al:y\left(mol\right)\end{matrix}\right.\)→ \(\left\{{}\begin{matrix}24x+27y=4,35\\x+1,5y=0,2\end{matrix}\right.\)→\(\left\{{}\begin{matrix}x=0,125\\y=0,05\end{matrix}\right.\)
Vậy :
\(\%m_{Mg} = \dfrac{0,125.24}{4,35}.100\% = 68,97\%\\ \%m_{Al} = 100\% - 68,97\% = 31,03\%\)
Đúng 3
Bình luận (0)
Cho 22,4 gam bột kim loại M vào dung dịch HCl dư, sau khi phản ứng kết thúc thu được 0,8 gam H2. Kim loại M là
A. Mg.
B. Ca
C. Fe
D. Zn
Đáp án C
Số mol H2 thu được là: n H 2 = 0 , 8 2 = 0 , 4 m o l
Gọi n là hóa trị của M
Phương trình hóa học:
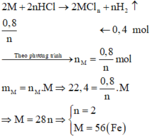
=> M là Fe
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 16,25 g kim loại M (chưa biết hóa trị) vào dung dịch axit HCL ,khi phản ứng kết thúc được 5,6 lít H2 điều kiện chuẩn
a.Tìm kim loại M trong các kim loại sau: Na = 23 ,Cu = 64, Zn= 65
b. tìm thể tích dung dịch HCl 0,2 M cần dùng để hòa tan hết kim loại
\(a/\\ M+2nHCl \to MCl_n+nH_2\\ n_{H_2}=\frac{5,6}{22,4}=0,25(mol)\\ n_M=\frac{1}{n}.n_{H_2}=\frac{1}{n}.0,25=\frac{0,25}{n}(mol)\\ M_M=\frac{16,25.n}{0,25}=65.n(g/mol)\\ \text{Chạy biện luân:}\\ \Rightarrow n=1; R=65(Zn)\\ b/\\ Zn+2HCl\to ZnCl_2+H_2\\ n_{HCl}=2.n_{H_2}=2.0,25=0,5(mol)\\ V_{HCl}=\frac{0,5}{0,2}=2,5M \)
Đúng 2
Bình luận (0)
Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Pt : M + 2HCl → MCl2 + H2\(|\)
1 2 1 1
0,25 0,25
a) Số mol của kim loại M
nM = \(\dfrac{0,25.1}{1}=0,25\left(mol\right)\)
⇒ MM = \(\dfrac{m_M}{n_M}=\dfrac{16,25}{0,25}=65\) (dvc)
Vậy kim loại M là Zn
b) Zn + 2HCl → ZnCl2 + H2\(|\)
1 2 1 1
0,25 0,5
Số mol của dung dịch axit clohidric
nHCl = \(\dfrac{0,25.2}{1}=0,5\left(mol\right)\)
Thể tích của dung dịch axit clohdric cần dùng
CMHCl = \(\dfrac{n}{V}\Rightarrow V=\dfrac{n}{C_M}=\dfrac{0,5}{0,2}=2,5\left(M\right)\)
Chúc bạn học tốt
Đúng 0
Bình luận (0)







