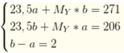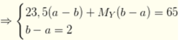đốt cháy 29,6 gam hỗn hợp kim loại Cu và Fe cần 6,72 lít khí õi ở đktc tạo ra hỗn hợp chất rắn gồm CuO và \(Fe_3O_4\) .tính khối lượng hỗn hợp chất rắn tạo ra
Tuyển Cộng tác viên Hoc24 nhiệm kì 26 tại đây: https://forms.gle/dK3zGK3LHFrgvTkJ6
\(2Cu + O_2 \xrightarrow{t^o} 2CuO\\ 3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\\ n_{O_2} = \dfrac{6,72}{22,4} = 0,3(mol)\\ \text{Bảo toàn khối lượng : } \\ m_{rắn\ tạo\ thành} = m_{kim\ loại} + m_{O_2} = 29,6 + 0,3.32 = 39,2(gam)\)
Đúng 2
Bình luận (0)
dùng \(H_2\) khử hoàn toàn 31,2 gam hỗn hợp CuO và \(Fe_3O_4\) trong hỗn hợp khối lượng \(Fe_3O_4\) lớn hơn khối lượng CuO là 15,2 gam.tính khối lượng Cu và Fe tạo ra
\(m_{Fe_3O_4} = \dfrac{31,2 + 15,2}{2} = 23,2(gam) \Rightarrow n_{Fe_3O_4} = \dfrac{23,2}{232} = 0,1(mol)\\ Fe_3O_4 + 4H_2 \xrightarrow{t^o} 3Fe + 4H_2O\\ n_{Fe} = 3n_{Fe_3O_4} = 0,3(mol) \Rightarrow m_{Fe} = 0,3.56 = 16,8(gam)\\ CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ n_{Cu} = n_{CuO} = \dfrac{31,2-23,2}{80} = 0,1(mol) \Rightarrow m_{Cu} = 0,1.64 = 6,4(gam)\)
Đúng 2
Bình luận (0)
Ta có:\(\left\{{}\begin{matrix}m_{CuO}+m_{Fe_3O_4}=31,2\\m_{Fe_3O_{\text{4}}}-m_{CuO}=15,2\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}m_{Fe_3O_4}=23.2\\m_{CuO}=8\end{matrix}\right.\)
\(n_{Fe_3O_4}=\dfrac{23,2}{232}=0,1\left(mol\right)\)
\(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
\(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\)
\(0,1\rightarrow\) 0.3
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(0,1\rightarrow\) 0,1
\(m_{Fe}=0,3.56=16,8\left(g\right)\)
\(m_{Cu}=0,1.64=6,4\left(g\right)\)
Đúng 1
Bình luận (0)
Cho biết 1 mol hỗn hợp khí X gồm CH4 và C2H2 nặng 23,5 gam. Trộn V1 lít X với V2 lít hiđrocacbon Y (ở thể khí) được hỗn hợp khí E nặng 271 gam. Trộn V2 lít X với V1 lít Y được hỗn hợp khí E nặng 206 gam. Biết V2 – V1 44,8 lít. Các khí đo ở điều kiện tiêu chuẩn. Công thức phân tử của Y là A.
C
3
H
6
B. C4H8. C. C4H6. D. C3H4.
Đọc tiếp
Cho biết 1 mol hỗn hợp khí X gồm CH4 và C2H2 nặng 23,5 gam. Trộn V1 lít X với V2 lít hiđrocacbon Y (ở thể khí) được hỗn hợp khí E nặng 271 gam. Trộn V2 lít X với V1 lít Y được hỗn hợp khí E nặng 206 gam. Biết V2 – V1 = 44,8 lít. Các khí đo ở điều kiện tiêu chuẩn. Công thức phân tử của Y là
A. C 3 H 6
B. C4H8.
C. C4H6.
D. C3H4.
Có 2 hỗn hợp sau:
- Hỗn hợp A gồm 11,2 gam sắt và 3,2 gam đồng.
- Hỗn hợp B gồm 4,2 gam liti và 4,8 gam magie.
Hỏi:
- Hỗn hợp nào nặng hơn?
- Hỗn hợp nào chứa nhiều mol nguyên tử hơn?
- Hỗn hợp nào chứa nhiều nguyên tử hơn?
-
mA = 11,2 + 3,2 = 14,4 (g)
mB = 4,2 + 4,8 = 9 (g)
=> hh A nặng hơn hh B
-
\(n_A=\dfrac{11,2}{56}+\dfrac{3,2}{64}=0,25\left(mol\right)\)
\(n_B=\dfrac{4,2}{7}+\dfrac{4,8}{24}=0,8\left(mol\right)\)
=> hh B có chứa nhiều mol nguyên tử hơn hh A
-
Do hh B có chứa nhiều mol nguyên tử hơn hh A
=> hh B có chứa nhiều nguyên tử hơn hh A
Đúng 1
Bình luận (0)
Thêm 3 gam MnO 2 vào 197 gam hỗn hợp X gồm KCl và KClO 3 . Trộn kĩ và đun hỗn hợp đến phản ứng hoàn toàn, thu được chất rắn cân nặng 152 gam. Khối lượng KCl trong 197 gam X là
A. 74,50 gam
B. 13,75 gam
C. 122,50 gam
D. 37,25 gam
Thêm 3 gam MnO2 vào 197 gam hỗn hợp X gồm KCl và KClO3. Trộn kĩ và đun hỗn hợp đến phản ứng hoàn toàn, thu được chất rắn cân nặng 152 gam. Khối lượng KCl trong 197 gam X là: A. 74,50 gam. B. 13,75 gam. C. 122,50 gam. D. 37,25 gam.
Đọc tiếp
Thêm 3 gam MnO2 vào 197 gam hỗn hợp X gồm KCl và KClO3. Trộn kĩ và đun hỗn hợp đến phản ứng hoàn toàn, thu được chất rắn cân nặng 152 gam. Khối lượng KCl trong 197 gam X là:
A. 74,50 gam.
B. 13,75 gam.
C. 122,50 gam.
D. 37,25 gam.
Đáp án A.
Bảo toàn khối lượng: mO2 = 3 + 197 – 152 = 48 (gam)
nO2 = 1,5 (mol)
2KClO3 → 2KCl + 3O2 ↑
⇒ mKCl = 197 – 1.122,5 = 74,5 (gam)
Đúng 0
Bình luận (0)
đốt m gam hỗn hợp Cu, Mg, Fe trong khí oxi thu đc 2,8g hỗn hợp X gồm CuO, MgO, \(Fe_3O_4\) . Hỗn hợp X td cừa đủ với V ml dung dịch \(H_2SO_4\) 1,0M đc dung dịch Y chỉ chứa muối trung hòa. Cô cạn dung dịch Y thu được 6,8 g muối khan. Gía trị của m và V
Có 2 hỗn hợp sau:
- Hỗn hợp A gồm 11,2 gam sắt và 3,25 gam kẽm.
- Hỗn hợp B gồm 2,7 gam nhôm và 4,8 gam magie.
Hỏi:
- Hỗn hợp nào nặng hơn?
- Hỗn hợp nào chứa nhiều mol nguyên tử hơn?
- Hỗn hợp nào chứa nhiều nguyên tử hơn?
Mình cần gấp nhe , mn gửi nhanh nhá
Hoà tan hết 12 gam hỗn hợp X gồm Fe, Cu bằng dung dịch H N O 3 dư, thu được 6,72 lít (đktc) hỗn hợp B gồm NO và N O 2 (không có sản phẩm khử khác) nặng 12,2 gam. Khối lượng muối nitrat sinh ra là
A. 34 gam.
B. 4,3 gam.
C. 43 gam.
D. 3,4 gam.
Cho 35,5g hỗn hợp A gồm Zn và \(Fe_2O_3\) tác dụng hết với dung dịch HCl thu được 6,72l khí (đ.k.t.c)
a) Tính khối lượng axit phản ứng
b) Dẫn khí sinh ra qua ống sứ chứa 19,6g hỗn hợp B gồm CuO và \(Fe_3O_4\) nung nóng thu được hỗn hợp X. Xác định khối lượng các chất trong X. H=60%
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\) (1)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\) (2)
a) Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\) \(\Rightarrow n_{HCl\left(1\right)}=0,6mol\)
Theo PTHH: \(n_{Zn}=n_{H_2}=0,3mol\) \(\Rightarrow m_{Zn}=0,3\cdot65=19,5\left(g\right)\)
\(\Rightarrow m_{Fe_2O_3}=16\left(g\right)\) \(\Rightarrow n_{HCl\left(2\right)}=6n_{Fe_2O_3}=6\cdot\dfrac{16}{160}=0,6\left(mol\right)\)
\(\Rightarrow\Sigma n_{HCl}=1,2mol\)
*Bạn cần bổ sung thêm nồng độ % dd HCl
Đúng 2
Bình luận (1)
Bạn tham khảo lời giải ở đây nhé!
Cho 35,5g hỗn hợp A gồm Zn và Fe2O3 tác dụng hết với dung dịch HCl thu được 6,72l khí ( ở đktc) a, tính khối lượng axit... - Hoc24
Đúng 1
Bình luận (0)