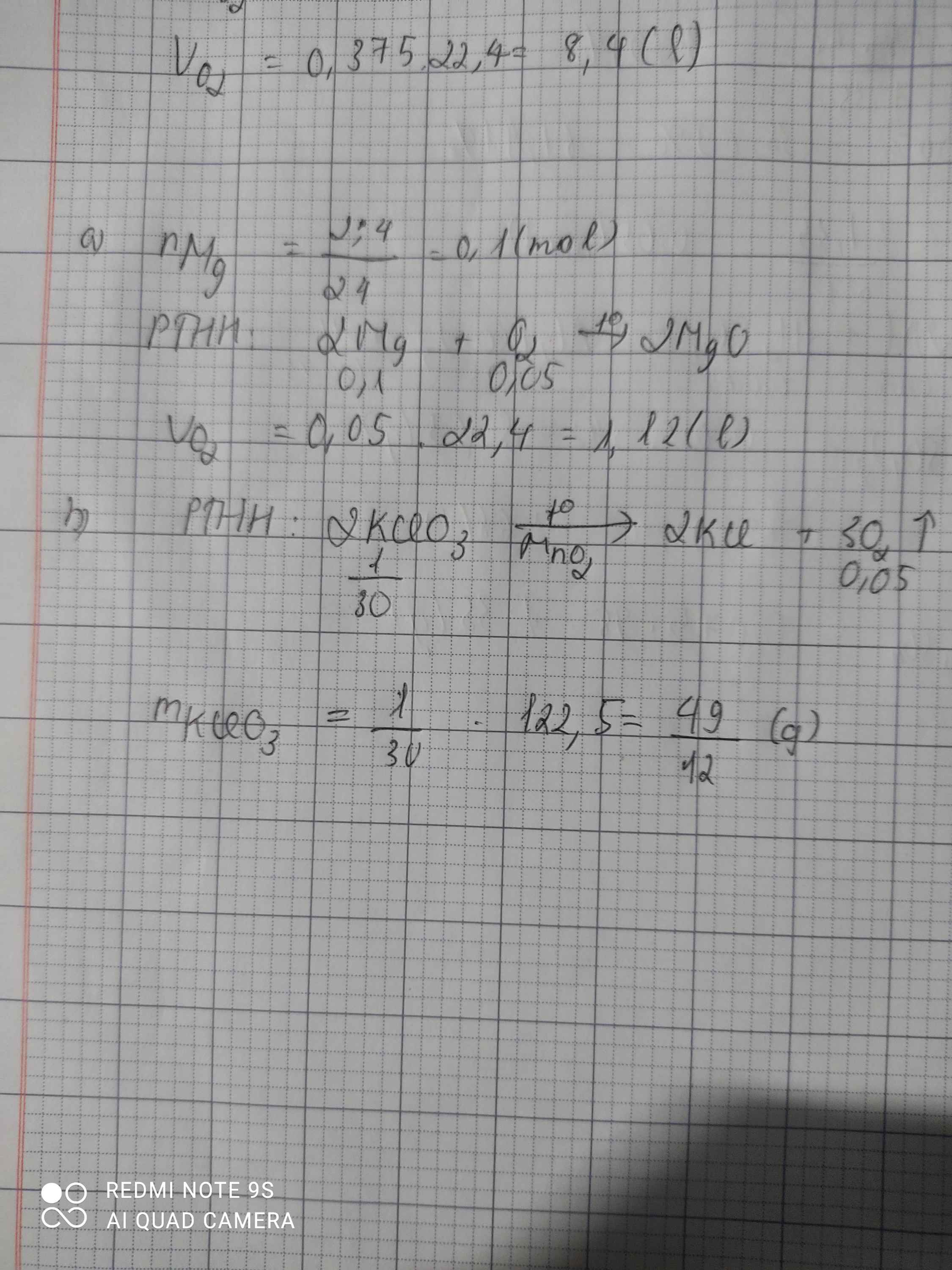TT
Những câu hỏi liên quan
Bài 1: Đốt cháy hoàn toàn 10,8 g Al trong lọ khí oxi. a) Tính thể tích oxi cần dùng ở đktc. b) Tính số gam KMnO4 cần dùng để điều chế lượng oxi trên.Bài 2: Để điều chế 16,8 g sắt người ta dùng khí hidro khử Fe2O3 ở nhiệt độ thích hợp. a) Viết phương trình phản ứng b) Tính khối lượng Fe2O3 cần dùng c) Tính thể tích khi hidro đã dùng (đktc).Bài 3: Cho 3,6 g magie tác dụng với dung dịch loãng có chứa 24,5g axit sunfuric.( H2SO4). Tính thể tích khí hiđro thu được ở đktc.
Đọc tiếp
Bài 1: Đốt cháy hoàn toàn 10,8 g Al trong lọ khí oxi.
a) Tính thể tích oxi cần dùng ở đktc.
b) Tính số gam KMnO4 cần dùng để điều chế lượng oxi trên.
Bài 2: Để điều chế 16,8 g sắt người ta dùng khí hidro khử Fe2O3 ở nhiệt độ thích hợp.
a) Viết phương trình phản ứng
b) Tính khối lượng Fe2O3 cần dùng
c) Tính thể tích khi hidro đã dùng (đktc).
Bài 3: Cho 3,6 g magie tác dụng với dung dịch loãng có chứa 24,5g axit sunfuric.
( H2SO4). Tính thể tích khí hiđro thu được ở đktc.
Bài 1: Số mol Al là 10,8/27=0,4 (mol).
4Al (0,4 mol) + 3O2 (0,3 mol) \(\underrightarrow{t^o}\) 2Al2O3.
a) Thể tích khí oxi cần dùng ở đktc là 0,3.22,4=6,72 (lít).
b) 2KMnO4 (0,6 mol) \(\underrightarrow{t^o}\) K2MnO4 + MnO2\(\downarrow\) + O2\(\uparrow\) (0,3 mol).
Khối lượng KMnO4 cần dùng là 0,6.158=94,8 (g).
Bài 2:
a) Fe2O3 (0,15 mol) + 3H2 (0,45 mol) \(\underrightarrow{t^o}\) 2Fe (0,3 mol) + 3H2O.
b) Khối lượng Fe2O3 cần dùng là 0,15.160=24 (g).
c) Thể tích khí hiđro đã dùng (đktc) là 0,45.22,4=10,08 (lít).
Bài 3: Số mol magie và axit sunfuric lần lượt là 3,6/24=0,15 (mol) và 24,5/98=0,25 (mol), H2SO4 dư.
Mg (0,15 mol) + H2SO4 (0,15 mol) \(\rightarrow\) MgSO4 + H2\(\uparrow\) (0,15 mol).
Thể tích khí hiđro thu được ở đktc là 0,15.22,4=3,36 (lít).
Đúng 1
Bình luận (2)
Bài 1:
Số mol của Al là:
nAl=10,8/27=0,4(mol)
PTHH: Al + O2 → Al2O3
0,4 → 0,4→ 0,4 (mol)
a)Thể tích của oxi ở đktc là:
VO2=0,4*22,4=8,96(l)
b) PTHH: 2KMnO4 → O2 + MnO2 + K2MnO4
0,8 0,4
Khối lượng của KMnO4 là:
mKMnO4=0,8*158=126,4(g)
Bài 2:
Số mol của sắt là:
nFe=16,8/56=0,3(mol)
a) PTHH: 4Fe + 3O2 → 2Fe2O3
0,3→0,225→ 0,15 (mol)
b) Khối lượng của Fe2O3 là:
mFe2O3=0,15*160=24(g)
c) Thể tích hidro cần dùng là:
VH2=0,225*22,4=5,04 (l)
Đúng 0
Bình luận (4)
Tính thể tích khí hidro và khí oxi (ở đktc) cần tác dụng với nhau để tạo ra 1,8 gam nước.
Đốt cháy hoàn toàn 2,4g magie (Mg) trong khí oxi thu được magie oxit (MgO)
a) Tính thể tích khí oxi cần dùng (thể tích khí đo ở đktc)
b) Tính số gam KClO3 cần dùng để điều chế lượng oxi trên
\(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\\ a,2Mg+O_2\rightarrow\left(t^o\right)2MgO\\ n_{O_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\\ b,2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\\ n_{KClO_3}=\dfrac{0,05.2}{3}=\dfrac{1}{30}\left(mol\right)\\ \Rightarrow m_{KClO_3}=\dfrac{122,5}{30}=\dfrac{49}{12}\left(g\right)\)
Đúng 1
Bình luận (0)
Câu 4. Đốt cháy hoàn toàn 100 gam Cu2S bằng oxi với hiệu suất là 96%, thu được chất rắn A và khí B. Lượng khí sinh ra dùng để điều chế axit sunfuric (H2SO4). Các khí đo ở đktc. a. Tính thể tích khí oxi cần dùng ở đktc và khối lượng oxit đồng thu được sau phản ứng. b. Tính lượng KMnO4 cần dùng để đốt lượng oxit trên. c. Nếu dùng không khí để đốt cháy thì thể tích không khí ở đktc cần dùng là bao nhiêu? Biết trong không khí chứa 21% là oxi. d. Tính khối lượng dung dịch axit sunfuric 10% thu được s...
Đọc tiếp
Câu 4. Đốt cháy hoàn toàn 100 gam Cu2S bằng oxi với hiệu suất là 96%, thu được chất rắn A và khí B. Lượng khí sinh ra dùng để điều chế axit sunfuric (H2SO4). Các khí đo ở đktc. a. Tính thể tích khí oxi cần dùng ở đktc và khối lượng oxit đồng thu được sau phản ứng. b. Tính lượng KMnO4 cần dùng để đốt lượng oxit trên. c. Nếu dùng không khí để đốt cháy thì thể tích không khí ở đktc cần dùng là bao nhiêu? Biết trong không khí chứa 21% là oxi. d. Tính khối lượng dung dịch axit sunfuric 10% thu được sau quá trình trên nếu hiệu suất của quá trình điều chế aixt sunfuric từ SO2 là 85%.
PTHH: \(Cu_2S+2O_2\xrightarrow[]{t^o}2CuO+SO_2\)
a) Ta có: \(n_{Cu_2S}=\dfrac{100}{160}=0,625\left(mol\right)\) \(\Rightarrow n_{O_2\left(lýthuyết\right)}=1,25\left(mol\right)\)
\(\Rightarrow V_{O_2\left(thực\right)}=\dfrac{1,25\cdot22,4}{96\%}\approx29,17\left(l\right)\)
b) Sửa đề: "Tính khối lượng KMnO4 để hấp thụ hết SO2"
PTHH: \(5SO_2+2KMnO_4+2H_2O\rightarrow K_2SO_4+2MnSO_4+2H_2SO_4\)
Ta có: \(n_{SO_2\left(thực\right)}=n_{Cu_2S}\cdot96\%=0,6\left(mol\right)\)
\(\Rightarrow n_{KMnO_4}=0,24\left(mol\right)\) \(\Rightarrow m_{KMnO_4}=0,24\cdot158=37,92\left(g\right)\)
c) PTHH: \(SO_2+\dfrac{1}{2}O_2\xrightarrow[V_2O_5]{t^o}SO_3\)
Theo PTHH: \(n_{O_2}=\dfrac{1}{2}n_{SO_2}=0,3\left(mol\right)\) \(\Rightarrow V_{kk}=\dfrac{0,3\cdot22,4}{21\%}=32\left(l\right)\)
d) Bảo toàn nguyên tố Lưu huỳnh: \(n_{H_2SO_4\left(lýthuyết\right)}=n_{SO_2\left(thực\right)}=0,3\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(thực\right)}=0,3\cdot85\%=0,255\left(mol\right)\) \(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,255\cdot98}{10\%}=249,9\left(g\right)\)
Đúng 2
Bình luận (0)
Tính thế tích khí hiđro và oxi ( ở đktc) cần tác dụng với nhau để tạo ra được 3,6 gam nước
\(PTHH:2H_2+O_2\rightarrow2H_2O\)
Số mol của 3,6 gam nc là:
\(n_{H_2O}=\dfrac{m}{M}=\dfrac{3,6}{18}=0,2\left(mol\right)\)
Thể tích khí Oxi là:
\(V_{O_2}=n.22,4=0,1.22,4=2,24\left(l\right)\)
Thể tích khí hidro là:
\(V_{H_2}=n.22,4=0,2.22,4=4,48\left(l\right)\)
Đúng 2
Bình luận (0)
\(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(m\right)\)
\(PTHH:2H_2+O_2->2H_2O\)
tỉ lệ :2 1 2
số mol :0,2 0,1 0,2
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
\(V_{O_2}=0,1.22,4=2,24\left(l\right)\)
Đúng 1
Bình luận (0)
đốt cháy 7,44 gam Photpho trong khí oxi ,thu được điphotpho pentaoxit a) Tính thể tích khí oxi đã phản ứng (ở đktc)? b) cần dùng bao nhiêu gam Kali clorat để điều chế được khí Oxi dùng cho phản ứng trên?
4P + 5O2 ----> 2P2O5
0,24 -> 0,3 ---> 0,12 (mol)
nP = \(\dfrac{7,44}{31}\)= 0,24 (mol)
VH2 = 0,3 . 22,4 = 6,72 (l)
2KClO3 ---> 2KCl + 3O2
0,2 <------------- 0,3 (mol)
mKClO3 = 0,2 . (39 + 35,5 + 16.3)
= 24,5 (g)
Vui lòng kiểm tra lại kết quả dùm, thank you.
Đúng 2
Bình luận (1)
nP = 7,44 : 31 = 0,24 ( mol)
pthh : 4P + 5O2 -t--> 2P2O5
0,24->0,3 (mol)
=> VO2 =0,3 . 22,4 = 6,72 (l)
pthh : 2KClO3 -t--> 2KCl + 3O2
0,2<-------------------0,3 (mol)
=> mKClO3 = 0,2 .122,5 = 24,5 (g)
Đúng 0
Bình luận (1)
cho 6,4 gam đoòng tác dụng vừa đủ với khí oxi ở đktc thu được đồng (II) oxit
a) tính thể tích khí oxi và khí cần dùng (ở đktc)
b) tính khối lượng đồng (II) oxit thu được
c) nếu dùng thể tích khí oxi ở trên để đốt cháy 2,4 gam R có hoá trị II, R là loại nào
\(2Cu+O_2\rightarrow\left(t^o\right)2CuO\\ n_{CuO}=n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right);n_{O_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\\ a,V_{O_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\\ V_{kk\left(đktc\right)}=\dfrac{100.1,12}{20}=5,6\left(l\right)\\ b,m_{CuO}=0,1.80=8\left(g\right)\\ c,2R+O_2\rightarrow\left(t^o\right)2RO\\ n_R=2.n_{O_2}=2.0,05=0,1\left(mol\right)\\ M_R=\dfrac{2,4}{0,1}=24\left(\dfrac{g}{mol}\right)\\ \Rightarrow R:Magie\left(Mg=24\right)\)
Đúng 0
Bình luận (1)
Câu hỏi : Cho 5,6 lít nước hidro tác dụng với 3,2g khíc Oxi tạo ra nướca) Viết phương trình hóa học b) Khí Oxi và khí hidro ,chất nào dư sau phân tử tính thể tích khí dư.Biết thể tích các khí đo ở đktc c) Tính Khối lượng nước thu được bằng 2 cách?d) Tính thể tích ko khí (đktc) cần dùng để đốt cháy hết lượng khí hidro trên biết thể tích oxi bằng 1/5 thể tích ko khí?
Đọc tiếp
Câu hỏi : Cho 5,6 lít nước hidro tác dụng với 3,2g khíc Oxi tạo ra nước
a) Viết phương trình hóa học
b) Khí Oxi và khí hidro ,chất nào dư sau phân tử tính thể tích khí dư.Biết thể tích các khí đo ở đktc
c) Tính Khối lượng nước thu được bằng 2 cách?
d) Tính thể tích ko khí (đktc) cần dùng để đốt cháy hết lượng khí hidro trên biết thể tích oxi bằng 1/5 thể tích ko khí>?
- Bạn ơi, 5,6 lít của nước hay hiđro
Đúng 1
Bình luận (1)
a) 2H2 +O2 -->2H2O
b) nH2=5,6/22,4=0,25(mol)
nO2=3,2/16=0,2(mol)
lập tỉ lệ :
\(\dfrac{0,25}{2}< \dfrac{0,2}{1}\)
=> H2 hết , O2 dư =>bài toán tính theo H2
theo PTHH : nO2=1/2nH2=0,125(mol)
nO2(dư)=0,2 -0,125=0,075(mol)
=>VO2(dư)=0,075.22,4=1,68(l)
c)
C1 : theo PTHH :nH2O=nH2=0,25(mol)
=>mH2O=0,25.18=4,5(g)
C2: mH2=0,25.2=0,5(g)
mO2(phản ứng)=0,125.32=4(g)
áp dụng định luật bảo toàn khối lượng ta có :
mH2O=4 +0,5=4,5(g)
d) Vo2(đktc)=0,125.22,4=2,8(l)
=> Vkk=2,8 : 1/5=14(l)
Đúng 0
Bình luận (0)
mik sửa lại:
nO2=3,2/32=0,1(mol)
lập tỉ lệ :
\(\dfrac{0,1}{1}< \dfrac{0,25}{2}\)
=>O2 hết ,H2 dư =>bài toán tính theo O2
theo PTHH :
nH2=2nO2=0,2(mol)
=>nH2(dư)=0,25 -0,2=0,05(mol)
=>VH2(dư)=0,05.22,4=1,12(l)
c) C1:
theo PTHH : nH2O=2nO2=0,2(mol)
=>mH2O=0,2.18=3,6(g)
C2: mH2=0,2.2=0,4(g)
áp dụng định luật bảo toàn khối lượng ta có :
mH2O=0,4 +3,2=3,6(g)
d) VO2=0,1.22,4=2,24(l)
=>Vkk=2,24 :1/5=11,2(l)
Đúng 0
Bình luận (0)
Bài 3: khi đốt cháy sắt trong khí oxi thu được oxit sắt từ Fe3O4. .Tính số gam sắt và thể tích oxi ( đktc ) cần dùng để điều chế 2,32g từ oxit sắt từ ( Fe=56, O=16)
Bài 4: Đốt chảy 6,2g P đỏ trong bình chứa 6,72 lít khí oxi ( ở đktc ) tạo thành P2O5
a) Chất nào còn dư, chất nào thiếu
b) Khối lượng chất tạo thành là bao ? ( P=31, O=16)
Bài 3 :
PTHH : \(6Fe+4O_2\left(t^o\right)->2Fe_3O_4\) (1)
\(n_{Fe_3O_4}=\dfrac{m}{M}=\dfrac{2,32}{56.3+16.4}=0,01\left(mol\right)\)
Từ (1) => \(3n_{Fe_3O_4}=n_{Fe}=0,03\left(mol\right)\)
=> \(m_{Fe}=n.M=1,68\left(g\right)\)
Từ (1) => \(2n_{Fe_3O_4}=n_{O_2}=0,02\left(mol\right)\)
=> \(V_{O_2\left(đktc\right)}=n.22,4=0,448\left(l\right)\)
Bài 4 :
PTHH : \(4P+5O_2\left(t^o\right)->2P_2O_5\) (1)
\(n_P=\dfrac{m}{M}=\dfrac{6,2}{31}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{V}{22,4}=\dfrac{6,72}{32}=0,21\left(mol\right)\)
Có : \(n_P< n_{O_2}\left(0,2< 0,21\right)\)
-> P hết ; O2 dư
Từ (1) -> \(\dfrac{1}{2}n_P=n_{P_2O_5}=0,1\left(mol\right)\)
=> \(m_{P_2O_5}=n.M=14,2\left(g\right)\)
Đúng 1
Bình luận (0)
Bài 3:
\(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
PTHH: 3Fe + 2O2 ---to→ Fe3O4
Mol: 0,03 0,02 0,01
\(m_{Fe}=0,03.56=1,68\left(g\right);V_{O_2}=0,02.22,4=0,448\left(l\right)\)
Đúng 0
Bình luận (1)
3Fe+2O2-to>Fe3O4
0,03-----0,02-------0,01 mol
n Fe3O4=\(\dfrac{2,32}{232}\)=0,01 mol
=>m Fe=0,03.56=1,68g
=>V O2=0,2.22,4=0,448l
bài 2
4P+5O2-to>2P2O5
0,2---------------0,1
n P=\(\dfrac{6,2}{31}\)=0,2 mol
n O2=\(\dfrac{6,72}{22,4}\)=0,3 mol
=>O2 dư , P hết
=>m P2O5= 0,1.142=14,2g
Đúng 0
Bình luận (0)