Nitơ trong thiên nhiên là hỗn hợp gồm hai đồng vị là N 7 14 (99,63%) và N 7 15 (0,37%). Nguyên tử khối trung bình của nitơ là
A. 14,7.
B. 14,0.
C. 14.4
D. 13,7.
Nito trong thiên nhiên là hỗn hợp của hai đồng vị gồm:14/7 N (99,63%) và 15/7N(0,37%). Nguyên tử khối trung bình của nitơ là?
\(\overline{NTK}_N=\dfrac{99,63\%.14+0,37\%.15}{100\%}=14,0037\left(đ.v.C\right)\)
Câu 1: (3,0 điểm). Cho nguyên tử Nitơ (Z = 7).
a) Xác định số proton và số electron của nguyên tử.
b) Xác định sự phân bố electron trên các lớp electron.
c) Nguyên tố Nitơ trong thiên nhiên là hỗn hợp gồm hai đồng vị là 14N7 (99,63%) và 15N7 (0,37%). Tính nguyên tử khối trung bình của Nitơ.
Nitơ trong thiên nhiên là hỗn hợp gồm hai đồng vị là 147N (99,63%) và A7N (0,37%). Trong HNO3 14N chiếm 22,1387% khối lượng. Nguyên tử khối của đồng vị thứ hai của Nitơ là:
A. 14.
B. 15.
C. 16.
D. 13.
Đáp án B
MN = 14 x 0,9963 + A x 0,0037
= 13,9482 + 0,0037A.
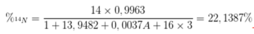
→ A = 15
Nitơ trong thiên nhiên là hỗn hợp gồm hai đồng vị có % về số nguyên tử tương ứng là 147N (99,63%) và 157N(0,37%). Nguyên tử khối trung bình của Nitơ là:
A. 14,7
B. 14,0
C. 14,4
D. 13,7
Nitơ trong thiên nhiên là hỗn hợp gồm hai đồng vị có % về số nguyên tử tương ứng là N 7 14 (99,63%) và N 7 15 (0,37%). Nguyên tử khối trung bình của nitơ là
A. 14,7.
B. 14,0.
C. 14,4.
D. 13,7.
Nitơ trong thiên nhiên là hỗn hợp gồm hai đồng vị có % về số nguyên tử tương ứng là N 7 14 (99,63%) và N 7 15 (0,37%). Nguyên tử khối trung bình của nitơ là
A. 14,7.
B. 14,0.
C. 14,4.
D. 13,7.
nitơ trong tự nhiên có hai đồng vị \(^{_{7^{ }}14}N\left(99,63\%\right)\) và \(^{_715}N\)(0,37%) . tính số nguyên tử của \(^{14}N\) trong 1,700074 g NaNO\(_3\)
\(\overline{A_N}=\dfrac{14.99,63+15.0,37}{100}\approx14,003\)
Xét 1 mol NaNO3
\(n_{NaNO_3}=\dfrac{1,700074}{85,003}\approx0,02\left(mol\right)\)
=> \(n_N=n_{NaNO_3}=0,02\)
Số nguyên tử N có trong NaNO3:
0,02.6,02.1023 = 1204.1019 (nguyen tư)
Số nguyên tử 14N : 99,63%.1204.1019
\(\approx1,1995.10^{22}\) (ngtu)
Nguyên tố nitrogen có hai đồng vị tự nhiên là \(\dfrac{14}{7}\)N và \(\dfrac{15}{7}\)N ,số loại phân tử N2 tồn tại bên trong khí quyển trái đất là? Giải thích?
Số loại phân tử N2: 3
CTHH của các phân tử N2: \(^{14}_7N^{14}_7N\), \(^{15}_7N^{15}_7N\) và \(^{14}_7N^{15}_7N\)
Trồng tự nhiên N gồm 2 đồng vị là 714N và 715N . Biết tỉ khối hơi của khí nitơ so vs H# là 14,003. Xác định % về khối lượng của đồng vị 714N có trong NaNO3 ( Na=23 , O =16)
gọi P1 là % đồng vị N(A=14) có trong tự nhiên
=> 100-P1 là % đồng vị N(A=15) có trong tự nhiên
theo giả thuyết ta có : 14,003 = \(\frac{14\cdot P1+15\cdot\left(100-P1\right)}{100}\)=> P1 = 99,7
% khối lượng đồng vị N( A = 14) có trong NaNO3 là :
%m = \(\frac{14\cdot99,7}{23+14,003+16\cdot3}\)=16,42%
Chúc bạn học tốt !