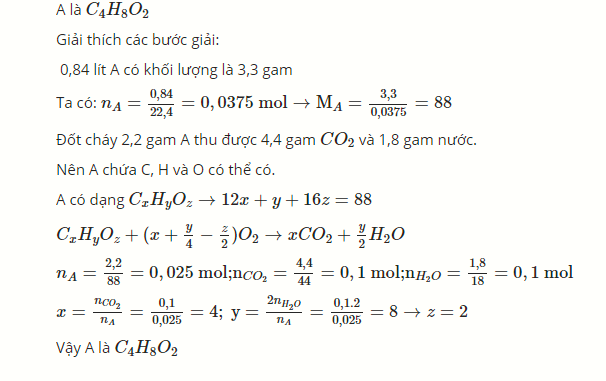Hợp chất hữu cơ A có tỉ khối đối với H 2 là 13. Khi đốt cháy 5,2 gam A thu được m gam CO 2 và a gam H 2 O. Cho toàn bộ lượng CO 2 thu được ở trên hấp thụ hết vào dung dịch Ca OH 2 dư thấy tạo ra 40 gam kết tủa. Hãy xác định công thức phân tử của A.
NN
Những câu hỏi liên quan
Đốt cháy hoàn toàn 5,2 gam chất hữu cơ A, thu được 17,6 gam CO2 và 3,6 gam H2O.a) Tìm CTPT của A.Biết A có tỷ khối đối với Hiđro là 13. c) Dẫn sản phẩm vào dung dịch nước vôi trong dư thu được m gam kết tủa. Tính m ?
Đọc tiếp
Đốt cháy hoàn toàn 5,2 gam chất hữu cơ A, thu được 17,6 gam CO2 và 3,6 gam H2O.
a) Tìm CTPT của A.Biết A có tỷ khối đối với Hiđro là 13.
c) Dẫn sản phẩm vào dung dịch nước vôi trong dư thu được m gam kết tủa. Tính m ?
a, \(n_{CO_2}=\dfrac{17,6}{44}=0,4\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(mol\right)\Rightarrow n_H=0,2.2=0,4\left(mol\right)\)
⇒ mC + mH = 0,4.12 + 0,4.1 = 5,2 (g) = mA
→ A chỉ gồm C và H.
Gọi CTPT của A là CxHy.
⇒ x:y = 0,4:0,4 = 1:1
→ CTPT của A có dạng là (CH)n.
Mà: MA = 13.2 = 26 (g/mol)
\(\Rightarrow n=\dfrac{26}{12+1}=2\)
Vậy: CTPT của A là C2H2.
c, PT: \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_{3\downarrow}+H_2O\)
Theo PT: \(n_{CaCO_3}=n_{CO_2}=0,4\left(mol\right)\Rightarrow m_{CaCO_3}=0,4.100=40\left(g\right)\)
Đúng 1
Bình luận (5)
A và B là hai hợp chất đều có tỉ khối đối với
H
2
là 14. Đốt cháy A thu được sản phẩm chỉ có
CO
2
. Đốt cháy 1,4 gam B thu được sản phẩm gồm 4,4 gam
CO
2
và 1,8 gam
H
2
O. Xác định công thức phân tử của A, B. Hãy cho biết...
Đọc tiếp
A và B là hai hợp chất đều có tỉ khối đối với H 2 là 14. Đốt cháy A thu được sản phẩm chỉ có CO 2 . Đốt cháy 1,4 gam B thu được sản phẩm gồm 4,4 gam CO 2 và 1,8 gam H 2 O. Xác định công thức phân tử của A, B. Hãy cho biết A, B là hợp chất hữu cơ hay vô cơ.
Ta có M A = M B = 14 x 2 = 28 (gam).
A là hợp chất khi đốt chỉ tạo ra CO 2 . Vậy A phải chứa cacbon và oxi. Mặt khác, M A = 28 gam → công thức của A là CO.
B khi cháy sinh ra CO 2 và H 2 O, vậy trong B có cacbon và hiđro.
Ta có m C = 4,4/44 x 12 = 1,2g
m H = 1,8/18 x 2 = 0,2g
Vậy m B = m C + m H = 1,2 + 0,2 = 1,4 (gam).
=> Trong B chỉ có 2 nguyên tố là C và H.
Gọi công thức phân tử của B là C x H y , ta có :
4 C x H y + (4x +y) O 2 → 4x CO 2 + 2y H 2 O
n C x H y = 1,4/28 = 0,05mol
=> x = 2 ; y = 4. Công thức của B là C 2 H 4
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn m gam hỗn hợp chất hữu cơ A chỉ thu được a gam CO2 và b gam H2O. Biết 11b 3a và 7m 3(a+b). Mặt khác ta có tỉ khối hơi của chất A đối với không khí nhỏ hơn 3. Công thức phân tử của chất hữu cơ A là: A. C3H8 B. C2H6 C. C3H4O2 D. C3H6O2
Đọc tiếp
Đốt cháy hoàn toàn m gam hỗn hợp chất hữu cơ A chỉ thu được a gam CO2 và b gam H2O. Biết 11b = 3a và 7m = 3(a+b). Mặt khác ta có tỉ khối hơi của chất A đối với không khí nhỏ hơn 3. Công thức phân tử của chất hữu cơ A là:
A. C3H8
B. C2H6
C. C3H4O2
D. C3H6O2
Đáp án C
Vì đốt cháy A thu được CO2 và H2O nên A chứa C, H, có thể có O.
Khi đó gọi công thức phân tử của A là CxHyOz
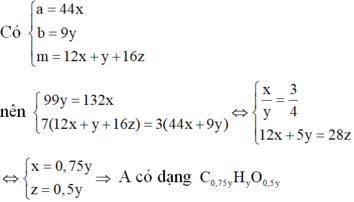
![]()
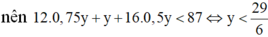
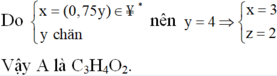
Nhận xét: Khi làm đến bước x : y = 3 :4 và kết hợp với quan sát 4 đáp án, ta có thể kết luận ngay A là C3H4O2.
Đúng 0
Bình luận (0)
Đốt cháy 3 gam một chất hữu cơ A thu được 4,4g CO2 và 1,8g H2O. Xác định công thức phân tử của A trong các trường hợp sau : a) A có khối lượng bằng 60 gam/mol b) Hợp chất hữu cơ A có tỉ khối đối với oxi là 1,875
Ta có: \(n_{CO_2}=\dfrac{4,4}{44}=0,1\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\Rightarrow n_H=0,1.2=0,2\left(mol\right)\)
⇒ mC + mH = 0,1.12 + 0,2.1 = 1,4 (g) < 3 (g)
→ A chứa C, H và O.
⇒ mO = 3 - 1,4 = 1,6 (g) \(\Rightarrow n_O=\dfrac{1,6}{16}=0,1\left(mol\right)\)
Gọi CTPT của A là CxHyOz,
⇒ x:y:z = 0,1:0,2:0,1 = 1:2:1
→ CTPT của A có dạng (CH2O)n.
a, MA = 60 (g/mol) \(\Rightarrow n=\dfrac{60}{12+2.1+16}=2\)
Vậy: CTPT của A là C2H4O2.
b, \(M_A=1,875.32=60\left(g/mol\right)\)
\(\Rightarrow n=\dfrac{60}{12+2.1+16}=2\)
Vậy: CTPT của A là C2H4O2.
Đúng 1
Bình luận (0)
A và B là hai hợp chất đều có tỉ khối đối với H2 là 14. Đốt cháy A thu được sản phẩm chỉ có CO2. Đốt cháy 1,4 gam B thu được sản phẩm gồm 4,4 game CO2 và 1,8 gam H2O. Xác định công thức phân tử của A,B. Hãy cho biết A,B là hợp chất hữu cơ hay vô cơ.
- Ta có: MA = MB = 14.2 = 28 (g/mol)
Mà đốt A chỉ thu CO2 ⇒ A là CO.
- Ta có: \(n_{CO_2}=\dfrac{4,4}{44}=0,1\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\Rightarrow n_H=0,1.2=0,2\left(mol\right)\)
⇒ mC + mH = 0,1.12 + 0,2.1 = 1,4 (g) = mB
→ B chỉ chứa C và H.
Gọi CTPT của B là CxHy.
⇒ x:y = 0,1:0,2 = 1:2
→ CTPT của B có dạng (CH2)n
\(\Rightarrow n=\dfrac{28}{12+2}=2\)
Vậy: B là C2H4.
- A là hợp chất vô cơ, B là hợp chất hữu cơ.
Đúng 2
Bình luận (0)
Câu 7: Đốt cháy hoàn toàn 10,8 gam hợp chất hữu cơ X ( C, H, O) thu được 13,44 lít CO2 (đktc) và10,8 gam H2 O. Biết tỉ khối của X so với khí oxi bằng 2,25. Công thức phân tử của XCâu 6: Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X thu được 5,6 lít CO2 (đktc) và 5,4 gam H2O.Biết tỉ khối của X so với CO2 bằng 2. Công thức phân tử của XCâu 8: Kết quả phân tích nguyên tố hợp chất X cho biết %mC 40% ; %mH 6,67% còn lại là oxi.Tỉ khối hơi của X so với khí oxi bằng 1,875. Công thức phân tử của X
Đọc tiếp
Câu 7: Đốt cháy hoàn toàn 10,8 gam hợp chất hữu cơ X ( C, H, O) thu được 13,44 lít CO2 (đktc) và
10,8 gam H2 O. Biết tỉ khối của X so với khí oxi bằng 2,25. Công thức phân tử của X
Câu 6: Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X thu được 5,6 lít CO2 (đktc) và 5,4 gam H2O.
Biết tỉ khối của X so với CO2 bằng 2. Công thức phân tử của X
Câu 8: Kết quả phân tích nguyên tố hợp chất X cho biết %mC = 40% ; %mH = 6,67% còn lại là oxi.
Tỉ khối hơi của X so với khí oxi bằng 1,875. Công thức phân tử của X
Câu 7:
\(n_{CO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
\(n_{H_2O}=\dfrac{10,8}{18}=0,6\left(mol\right)\)
Bảo toàn C: nC = 0,6 (mol)
Bảo toàn H: nH = 1,2 (mol)
=> \(n_O=\dfrac{10,8-0,6.12-1,2}{16}=0,15\left(mol\right)\)
=> nC : nH : nO = 0,6 : 1,2 : 0,15 = 4:8:1
=> CTPT: (C4H8O)n
Mà M = 2,25.32 = 72(g/mol)
=> n = 1
=> CTPT: C4H8O
Câu 6
\(n_{CO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\)
Bảo toàn C: nC = 0,25 (mol)
Bảo toàn H: nH = 0,6 (mol)
=> \(n_O=\dfrac{4,4-0,25.12-0,6.1}{16}=0,05\left(mol\right)\)
nC : nH : nO = 0,25 : 0,6 : 0,05 = 5:12:1
=> CTPT: (C5H12O)n
Mà M = 44.2=88(g/mol)
=> n = 1
=> CTPT: C5H12O
Câu 8:
MX = 1,875.32 = 60 (g/mol)
Giả sử có 1 mol chất X => mX = 60.1 = 60 (g)
\(m_C=\dfrac{60.40}{100}=24\left(g\right)=>n_C=\dfrac{24}{12}=2\left(mol\right)\)
\(m_H=\dfrac{60.6,67}{100}=4\left(g\right)=>n_H=\dfrac{4}{1}=4\left(mol\right)\)
\(m_O=60-24-4=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> Trong 1 mol X chứa 2 mol C, 4 mol H, 2 mol O
=> CTPT: C2H4O2
Đúng 2
Bình luận (0)
Câu 7: Đốt cháy hoàn toàn 10,8 gam hợp chất hữu cơ X ( C, H, O) thu được 13,44 lít CO2 (đktc) và10,8 gam H2 O. Biết tỉ khối của X so với khí oxi bằng 2,25. Công thức phân tử của XCâu 6: Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X thu được 5,6 lít CO2 (đktc) và 5,4 gam H2O.Biết tỉ khối của X so với CO2 bằng 2. Công thức phân tử của XCâu 8: Kết quả phân tích nguyên tố hợp chất X cho biết %mC 40% ; %mH 6,67% còn lại là oxi.Tỉ khối hơi của X so với khí oxi bằng 1,875. Công thức phân tử của X
Đọc tiếp
Câu 7: Đốt cháy hoàn toàn 10,8 gam hợp chất hữu cơ X ( C, H, O) thu được 13,44 lít CO2 (đktc) và
10,8 gam H2 O. Biết tỉ khối của X so với khí oxi bằng 2,25. Công thức phân tử của X
Câu 6: Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X thu được 5,6 lít CO2 (đktc) và 5,4 gam H2O.
Biết tỉ khối của X so với CO2 bằng 2. Công thức phân tử của X
Câu 8: Kết quả phân tích nguyên tố hợp chất X cho biết %mC = 40% ; %mH = 6,67% còn lại là oxi.
Tỉ khối hơi của X so với khí oxi bằng 1,875. Công thức phân tử của X
Hỗn hợp M gồm hai chất hữu cơ A và B (phân tử A có nhiều hơn phân tử B một nguyên tử cacbon). Đốt cháy hoàn toàn 12,96 gam hỗn hợp M bằng lượng khí oxi dư thu được sản phẩm cháy gồm H2O và 36,96 gam CO2. Biết tỉ khối hơi của hỗn hợp M so với H2 là 13,5.a) Tìm công thức phân tử và tính thành phần phần trăm theo khối lượng mỗi chất có trong hỗn hợp M.b) Khi dẫn toàn bộ sản phẩm cháy vào 552,9 gam dung dịch Ba(OH)2 20,72% thu được m gam chất kết tủa và dung dịch Z. Tìm giá trị của m và tính nồng độ...
Đọc tiếp
Hỗn hợp M gồm hai chất hữu cơ A và B (phân tử A có nhiều hơn phân tử B một nguyên tử cacbon). Đốt cháy hoàn toàn 12,96 gam hỗn hợp M bằng lượng khí oxi dư thu được sản phẩm cháy gồm H2O và 36,96 gam CO2. Biết tỉ khối hơi của hỗn hợp M so với H2 là 13,5.
a) Tìm công thức phân tử và tính thành phần phần trăm theo khối lượng mỗi chất có trong hỗn hợp M.
b) Khi dẫn toàn bộ sản phẩm cháy vào 552,9 gam dung dịch Ba(OH)2 20,72% thu được m gam chất kết tủa và dung dịch Z. Tìm giá trị của m và tính nồng độ C% của chất tan có trong dung dịch Z
đốt cháy hoàn toàn 2.2 gam hợp chất hữu cơ A thu được 4.4 gam CO₂ và 1.8 gam H₂O, ngoài ra không còn chất nào khác. Biết rằng 0.84 lít hơi hợp chất A(đktc) có khối lượng là 3.3 gam. Xác định CTPT của hợp chất A
Đốt cháy A thu được sản phẩm chứa C, H, O
=> A chứa C, H và có thể có O
\(n_{CO_2}=\dfrac{4,4}{44}=0,1\left(mol\right)\Rightarrow n_C=0,1\left(mol\right)\)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\Rightarrow n_H=0,2\left(mol\right)\)
Xét mC + mH = 0,1.12 + 0,2.1 = 1,4 (g) < 2,2 (g)
=> A chứa C, H, O
\(n_O=\dfrac{2,2-1,4}{16}=0,05\left(mol\right)\)
Xét nC : nH : nO = 0,1 : 0,2 : 0,05 = 2 : 4 : 1
=> CTPT: (C2H4O)n
\(M_A=\dfrac{3,3}{\dfrac{0,84}{22,4}}=88\left(g/mol\right)\)
=> n = 2
=> CTPT: C4H8O2
Đúng 2
Bình luận (0)
\(n_A=\dfrac{0,84}{22,4}=0,0375 (mol) \Rightarrow M_A = {3,3}{0,0375}=88 ( mol) \)
\(A có dạng : C_xH_yO_z \rightarrow 12x+y+16z = 88 \)
\(C_xH_yO_z + ( x+\dfrac{y}{4}-\dfrac{z}{2}) O_2 \rightarrow xCO_2+\dfrac{x}{y}H_2O \)
\(n_A = \dfrac{2,2}{88}=0,025 (mol) \)
\(n_{CO_2} = \dfrac{4,4}{44}=0,1(mol) \)
\(n_{H_2O} = \dfrac{1,8}{18}=0,1(mol) \)
\(x=\dfrac{n_{CO_2}}{n_A} = \dfrac{0,1}{0,025}=4;y=\dfrac{2n_{H_2O}}{n_A} =\dfrac{0,1.2}{0,025}=8 \rightarrow z=2\)
Đúng 0
Bình luận (0)