Một bình chứa 4,8 lít khí hiđrô ở 5 . 10 5 P a ở 14 o C . Người ta tăng nhiệt độ của khí lên tới 26 o C . Vì bình không thật kín nên có một phần khí thoát ra ngoài và áp suất trong bình không thay đổi. Tính khối lượng khí thoát ra ngoài biết khối lượng mol của hiđrô là 2 . 10 - 3 k g / m o l .
HL
Những câu hỏi liên quan
Một bình chứa 4,8 lít khí hiđrô ở
5
.
10
5
P
a
ở
14
∘
C
. Người ta tăng nhiệt độ của khí lên tới
26
°
C
. Vì bình không thật kín nên có một phần khí thoát ra ngoài và áp suất trong bình không thay đổi. Biết khối lượng mol của hiđrô là
μ
2
.
10
-...
Đọc tiếp
Một bình chứa 4,8 lít khí hiđrô ở 5 . 10 5 P a ở 14 ∘ C . Người ta tăng nhiệt độ của khí lên tới 26 ° C . Vì bình không thật kín nên có một phần khí thoát ra ngoài và áp suất trong bình không thay đổi. Biết khối lượng mol của hiđrô là μ = 2 . 10 - 3 k g / m o l . Khối lượng khí thoát ra ngoài là:
A. 9 , 09 . 10 - 5 k g
B. 7 , 08 . 10 - 5 k g
C. 10 , 7 . 10 - 5 k g
D. 8 , 07 . 10 - 5 k g
Chọn D.
Áp dụng phương trình Cla-pê-rôn – Men-đê-lê-ép:
+ Trạng thái 1 (khi chưa tăng nhiệt độ):
Khối lượng m1, p1 = 5.105 Pa, V1 = 4,8 lít, T1 = 287 K
Từ phương trình:
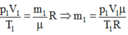
+ Trạng thái 2 (khi đã tăng nhiệt độ):
Khối lượng m2, p2 = p1 = 5.105 Pa, V2 = V1 = 4,8 lít, T2 = 26 + 273 = 287 K.
Từ phương trình:
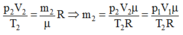
Khối lượng khí thoát ra ngoài:
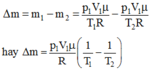
Thay số:
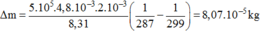
Đúng 0
Bình luận (0)
Bình chứa được 4g hiđrô ở 53
°
C
dưới áp suất
44,4.10
5
N
/
m
2
. Thay Hiđrô bởi khí khác thì bình chứa được 8g khí mới ở 27
°
C
dưới áp suất 5.
10
5
pa. Khí thay Hiđro là khí gì? Biết khí này là đơn chất. A.
O
2
B.
N
2
C.He D.
C
l...
Đọc tiếp
Bình chứa được 4g hiđrô ở 53 ° C dưới áp suất 44,4.10 5 N / m 2 . Thay Hiđrô bởi khí khác thì bình chứa được 8g khí mới ở 27 ° C dưới áp suất 5. 10 5 pa. Khí thay Hiđro là khí gì? Biết khí này là đơn chất.
A. O 2
B. N 2
C.He
D. C l 2
Đáp án: A
- Khi khí trong bình là Hiđrô: m 1 = 4 g T 1 = 53 + 273 = 326 K p 1 = 44,4.10 5 P a M 1 = 2
- Khi thay khí trong bình bằng khí X: m 2 = 8 g T 2 = 27 + 273 = 300 K p 2 = 5.10 5 P a M 2 = ?
Ta có thể tích bình chứa không thay đổi, viết phương trình Cla-pe-rôn - Men-đê-lê-ép cho hai trường hợp ta có:
V 1 = m 1 M 1 R T 1 p 1 1 V 2 = m 2 M 2 R T 2 p 2 2
Ta có:
V 1 = V 2 ↔ m 1 M 1 R T 1 p 1 = m 2 M 2 R T 2 p 2 ↔ 4 2 326 44,4.10 5 = 8 M 2 300 5.10 5 → M 2 ≈ 32
=> Chất khí được thay là O 2 có M=32
Đúng 0
Bình luận (0)
Một bình có dung tích V = 10 lít chứa một lượng khí hiđrô bị nén ở áp suất p = 50atm và nhiệt độ 7 ° . Khi nung nóng bình, do bình hờ nên có một phần khí thoát ra; phần khí còn lại có nhiệt độ 17 ° C và vẫn dưới áp suất như cũ. Tính khối lượng khí đã thoát ra.
Gọi m i , rrn là khối lượng khí trong bình trước và sau khi nung nóng bình.
Áp dụng phương trình Menđêlêep - Clapêrôn ta có:
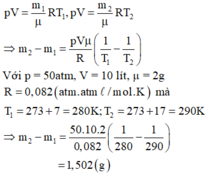
Đúng 0
Bình luận (0)
Một bình kín dung tích 10 lít chứa đầy không khí ở dktc. Người ta nạp thêm vào bình 5 lít không khí (đktc). Sau đó nung bình đến 273°C. Hỏi áp suất cuối cùng trong bình là bao nhiêu ?
Một bình có dung tích V = 10 lít chứa một lượng khí hiđrô bị nén ở áp suất p = 50atm và nhiệt độ 70. Khi nung nóng bình, do bình hở nên có một phần khí thoát ra; phần khí còn lại có nhiệt độ 170C và vẫn dưới áp suất như cũ. Tính khối lượng khí đã thoát ra.
Gọi m1, m2 là khối lượng khí trong bình trước và sau khi nung nóng bình. Áp dụng phương trình Menđêlêep – Clapêrôn ta có:
p V = m 1 μ R T 1 , p V = m 2 μ R T 2 . ⇒ m 2 − m 1 = p V μ R ( 1 T 1 − 1 T 2 )
Với p = 50atm, V = 10 lít, μ = 2 g
R = 0 , 082 ( a t m . l / m o l . K ) Mà T 1 = 273 + 7 = 280 K ; T 2 = 273 + 17 = 290 K
⇒ m 2 − m 1 = 50.10.2 0 , 082 ( 1 280 − 1 290 ) m 2 - m 1 = 1 , 502 ( g )
Đúng 0
Bình luận (0)
Làm thí nghiệm người ta thấy bình chứa 1kg khí nitơ bị nổ ở nhiệt độ 350 ° C. Tính khối lượng khí hiđrô có thế chứa trong bình cùng loại nếu nhiệt độ tối đa bị nổ là 50 ° C và hệ số an toàn là 5, nghĩa là áp suất tối đa chỉ bằng 1/5 áp suất gây nổ. Cho H = 1; N = 14; R = 8,31J/mol.K.
+ Gọi V là thể tích của bình và p n là áp suất gây nổ.
+ Đối với khí nitơ ta có:
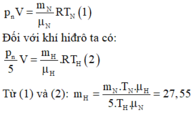
Đúng 0
Bình luận (0)
trong một buổi thực hành thí nghiêm cô giáo yêu cầu học sinh lấy 6 gam kim loại Magie sau đó cho vào dung dịch HCl lấy dư đến khi MgCl2 và khí hiđrô.
a) Viết PTHH
b) tính thể tích hiđrô thu được ở điều kiện tiêu chuẩn
c) Đem đốt toàn bộ lượng khí hiđrô sinh ra ở trên trong bình chứa 4,48 lít khí oxi (đktc). Tính khối lượng nước sinh ra sau phản ứng trên
a) Ta có:
nMg= \(\frac{m_{Mg}}{M_{Mg}}=\frac{6}{24}=0,25\left(mol\right)\)
PTHH: Mg + 2HCl -> MgCl2 + H2 (1)
PTHH: 2H2 + O2 \(\underrightarrow{t^o}\) 2H2O (2)
b) Theo các PTHH và đề bài , ta có:
\(n_{H_2}\)= nMg= 0,25 (mol)
Thể tích khí H2 thu được (đktc):
=> \(V_{H_2\left(đktc\right)}=n_{H_2\left(1\right)}.22,4=0,25.22,4=5,6\left(l\right)\)
c) Ta có: \(n_{H_2\left(2\right)}=n_{H_2\left(1\right)}=0,25\left(mol\right)\)
Mà, ta lại có: \(n_{H_2O\left(2\right)}=n_{H_2\left(2\right)}=0,25\left(mol\right)\)
=> \(m_{H_2O\left(2\right)}=n_{H_2O\left(2\right)}.M_{H_2O}=0,25.18=4,5\left(g\right)\)
Đúng 0
Bình luận (0)
Người ta điều chế khí hiđrô và chứa vào một bình lớn dưới áp suất 1 atm, ở nhiệt độ 20 ° C. Tính thể tích khí phải lấy từ bình lớn ra để nạp vào một bình nhỏ thể tích 20 lít dưới áp suất 25 atm. Coi nhiệt độ không đổi.
V 1 = p 2 V 2 / p 1 = 25.20/1 = 500 lít
Đúng 0
Bình luận (0)
Một bình bằng thép dung tích 62 lít chứa khí hiđrô ở áp suất 4,5Mpa và nhiệt độ
27
o
C
. Dùng bình này bơm được bao nhiêu quả bóng bay, dung tích mỗi quả 8,5 lít, tới áp suất
1
,
05
.
10
5
P
a
. Nhiệt độ khí trong bóng bay là
13
o
C
.
Đọc tiếp
Một bình bằng thép dung tích 62 lít chứa khí hiđrô ở áp suất 4,5Mpa và nhiệt độ 27 o C . Dùng bình này bơm được bao nhiêu quả bóng bay, dung tích mỗi quả 8,5 lít, tới áp suất 1 , 05 . 10 5 P a . Nhiệt độ khí trong bóng bay là 13 o C .



