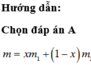Trồng tự nhiên N gồm 2 đồng vị là 714N và 715N . Biết tỉ khối hơi của khí nitơ so vs H# là 14,003. Xác định % về khối lượng của đồng vị 714N có trong NaNO3 ( Na=23 , O =16)
NT
Những câu hỏi liên quan
Trồng tự nhiên N gồm 2 đồng vị là 714N và 715N . Biết tỉ khối hơi của khí nitơ số vs H2 là 14,003. Xác định % về khối lượng của đồng vị 714N có trong NaNO3 ( Na =23 , O =16)
gọi P1 là % đồng vị N ( A = 14 )
theo giả thuyết ta có : 14,003 = \(\frac{14\cdot P1+15\cdot\left(100-P1\right)}{100}\)=> P1 =99,7
% về khối lượng của đồng vị N ( A = 14) có trong NaNO3 là:
%m = \(\frac{99,7\cdot14}{23+14,003+16\cdot3}\)= 16,42%
Bạn không hiểu có thể hỏi lại mình <3
Đúng 0
Bình luận (0)
Nitơ tự nhiên có khối lượng nguyên tử m14,00670u và gồm hai đồng vị chính là
N
7
14
có khối lượng nguyên tử
m
1
14
,
00307
u
và
N
7
15
có khối lượng nguyên tử
m
2
15
,
0001
u
. Tỉ lệ phần trăm của đồ...
Đọc tiếp
Nitơ tự nhiên có khối lượng nguyên tử m=14,00670u và gồm hai đồng vị chính là N 7 14 có khối lượng nguyên tử m 1 = 14 , 00307 u và N 7 15 có khối lượng nguyên tử m 2 = 15 , 0001 u . Tỉ lệ phần trăm của đồng vị N 7 15 có trong tự nhiên là
A. 89,88%.
B. 99,64%.
C. 78,94%.
D. 0,36%.
Đáp án B
Trong 100 nguyên tử nitơ tự nhiên có x nguyên tử N 7 14 và (100-x) nguyên tử N 7 15 . Do đó:
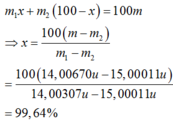
Đúng 0
Bình luận (0)
Nitơ tự nhiên có khối lượng nguyên tử là 14,0067u gồm 2 đồng vị là
N
14
và
N
15
có khối lượng nguyên tử lần lượt là 14,00307u và 15,00011u. Phần trăm của
N
15
trong nitơ tự nhiên: A. 0,36% B. 0,59% C. 0,43% D. 0,68%
Đọc tiếp
Nitơ tự nhiên có khối lượng nguyên tử là 14,0067u gồm 2 đồng vị là N 14 và N 15 có khối lượng nguyên tử lần lượt là 14,00307u và 15,00011u. Phần trăm của N 15 trong nitơ tự nhiên:
A. 0,36%
B. 0,59%
C. 0,43%
D. 0,68%
Tính tỉ khối hơi của hỗn hợp Y có đồng khối lượng gồm khí C2H2 , N2 và khí C0 so vs khí H2 ??
Một hỗn hợp đồng khối lượng khí C2H2, N2 và khí CO => Khối lượng N2 = Khối lượng CO = Khối lượng C2H2
=> Tỉ khối của hỗn hợp Y so với khí H2 là
\(\dfrac{12.2+1.2+14.2+12+16}{1.2}\)= 41
Đúng 1
Bình luận (0)
mình mấy bài hóa lớp 8 này nhabài 1:tìm khối lượng mol của các chất khí biết :a) tỉ khối đối với Hidro lần lượt là : 8; 8,5 ; 16 ; 22b ) tỉ khối đối với không khí lần lượt là : 0,138 ; 1,172 ; 2,448 ; 0,965Hãy cho biết M tìm được ở trên phù hợp với tên chất nào cho sao : Cacboni , CH4,Amoniac , oxi , heli , hidrosunfua, clo,nitowbái 2 : xác định Công thức hóa học của 1 đơn chất ở thể khí có tỉ khối đối với không khí là 0,009bài 3 hỗn hợp A gồm Hidro và oxi có tỉ khối so với không khí là 0,32...
Đọc tiếp
mình mấy bài hóa lớp 8 này nha
bài 1:tìm khối lượng mol của các chất khí biết :
a) tỉ khối đối với Hidro lần lượt là : 8; 8,5 ; 16 ; 22
b ) tỉ khối đối với không khí lần lượt là : 0,138 ; 1,172 ; 2,448 ; 0,965
Hãy cho biết M tìm được ở trên phù hợp với tên chất nào cho sao : Cacboni , CH4,Amoniac , oxi , heli , hidrosunfua, clo,nitow
bái 2 : xác định Công thức hóa học của 1 đơn chất ở thể khí có tỉ khối đối với không khí là 0,009
bài 3 hỗn hợp A gồm Hidro và oxi có tỉ khối so với không khí là 0,3276
a tính khối lượng mol rung bình của mỗi hỗn hợp
b tính tỉ lệ % theo số mol mỗi khí trong hỗ hợp
Bài 4 Biết A là hỗn hợp của nitơ và oxi .Tìm tỉ khối của hỗ hợp A với Hidro trong 2 trường hợp sau
a đồng thể tích , cùng điều kiện
b đồng khối lượng
Bài 5 cho 15 l hỗn hợp khí CO2 và CO điều kiện tiêu chẩn có khooisluowngj laf27,18 g. có bao nhiêu lít mỗi khí trong hỗ hợp . tính tỉ khối hơi của mỗi hỗn hợp
Bài 6 cho hỗ hợp gồm NO và N2O CÓ TỈ KHỐI SO VỚ H2 là 16,5 . tính thành phần % theo khối lượng thành phần mỗi trong hỗ hợp
Bài 7 hỗn hợp gồm Nitơ , hidro và amoniac có tỉ khối so với h2
Là 6,8 . tìm % theo thể tích và % theo khối lượng của hỗn hợp biết mol của hidro gấp 3 lần số mol của nitơ
1, a, + 8.2=16 => CH4
+ 8,5 . 2 = 17 => NH3
+ 16 . 2 =32 => O2
+ 22 . 2 = 44 => CO2
b, + 0,138 . 29 \(\approx4\) => He
+ 1,172 . 29 \(\approx34\) => H2S
+ 2,448 . 29 \(\approx71\Rightarrow Cl_2\)
+ 0,965 . 29 \(\approx28\) => N
Đúng 1
Bình luận (0)
Một hợp chất khí có thành phần % theo khối lượng của các nguyên tố là 82,35%N và còn lại là H
a.tìm CTHH của hợp chất khí biết hợp chất này có tỉ khối so với khí Hidro là 8,5
b.đốt cháy khí này thu được khí Nitơ và hơi nước. tính thể tích không khí cần dùng (đktc) để đốt cháy hết 3,4g khí trên
Cứu gấp
Xác định CTHH của khí metan, biết thành phần nguyên tố gồm C và H, tỉ khối hơi của khí metan so với khí heli là 4
\(M_{Metan}=4.M_{He}=4.4=16\left(\dfrac{g}{mol}\right)\)
Trong các hợp chất với H thì C thường có hoá trị IV.
\(Đặt.CTTQ:C_a^{IV}H_b^I\left(a,b:nguyên,dương\right)\\ Quy.tắc.hoá.trị:a.IV=b.I\\ \Leftrightarrow\dfrac{a}{b}=\dfrac{I}{IV}=\dfrac{1}{4}\\ \Rightarrow a=1;b=4\\ \Rightarrow CTTQ:\left(CH_4\right)_n\\ \Leftrightarrow16n=16\\ \Leftrightarrow n=1\\ \Rightarrow CTHH:CH_4\)
Đúng 4
Bình luận (0)
Mọi người giải giúp em bài này đc kh ạ
Tính tỉ khối hơi của hỗn hợp Y có đồng khối lượng gồm khí C2H2 (etilen) N2 và khí C) so vs khí H2 ??
- Khí etilen là C2H4 mà bạn. Còn khí C) là gì? Đó có phải là khí CO?
Đúng 0
Bình luận (0)
bn di hc them ha?
hc j ma nhah zu z
Đúng 0
Bình luận (0)
Một oxit A của nitơ có chứa 30,43% N về khối lượng. Tỉ khối hơi của A so với không khí là 1,586. A là A. NO. B. N2O C. NO2 D. N2O3.
Đọc tiếp
Một oxit A của nitơ có chứa 30,43% N về khối lượng. Tỉ khối hơi của A so với không khí là 1,586. A là
A. NO.
B. N2O
C. NO2
D. N2O3.