Oxit của một hợp chất kim loại có chứa % M là 58% biết khối lượng M của oxit là 102 gam . Tìm M .
Tuyển Cộng tác viên Hoc24 nhiệm kì 26 tại đây: https://forms.gle/dK3zGK3LHFrgvTkJ6
Nung 22,2g một muối của kim loại M sau phản ứng kết thúc thu được m gam chất rắn B là oxit bazo của kim loại M . (Trong oxit M chiếm 60% về khối lượng) và 8,4 lít hỗn hợp khí C (NO2 và O2) có tỷ khối so với H2 là 21,6. Xác định công thức phân tử của A và B
Cho 20,16 l khí CO (đktc) qua hỗn hợp chứa một lượng oxit của kim loại M (chưa rõ hóa trị), nung nóng. Sau khi pứ xảy ra hoàn toàn, thu được 25,2 gam kim loại M và hỗn hợp khí X có tỉ khối so với H2 = 58/3. Cho toàn bộ X qua bình chứa dung dịch nước vôi trong dư, tạo ra m gam muối CaCO3 kết tủa. Hòa tan hoàn toàn lượng kim loại M bằng dung dịch HCl dư thu được 10,08 l H2 (đktc).
a. Xác định CTHH của oxit
b. Tính giá trị của m
Giúp em với:(
a, - Hh khí X gồm: CO2 và CO dư.
BTNT C, có: \(n_{CO_2}+n_{CO\left(dư\right)}=\dfrac{20,16}{22,4}=0,9\left(mol\right)\left(1\right)\)
Mà: dX/H2 = 58/3 \(\Rightarrow\dfrac{44n_{CO_2}+28n_{CO\left(dư\right)}}{n_{CO_2}+n_{CO\left(dư\right)}}=\dfrac{58}{3}.2\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CO_2}=0,6\left(mol\right)\\n_{CO\left(dư\right)}=0,3\left(mol\right)\end{matrix}\right.\)
Bản chất pư: \(CO+O\rightarrow CO_2\)
⇒ nO (trong oxit) = nCO2 = 0,6 (mol)
- \(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
Giả sử M có hóa trị n.
PT: \(2M+2nHCl\rightarrow2MCl_n+nH_2\)
Theo PT: \(n_M=\dfrac{2}{n}n_{H_2}=\dfrac{0,9}{n}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{25,2}{\dfrac{0,9}{n}}=28n\left(g/mol\right)\)
Với n = 2 thì MM = 56 (g/mol)
→ M là Fe. ⇒ nM = 0,45 (mol)
Gọi CTHH của oxit là FexOy
⇒ x:y = 0,45:0,6 = 3:4
Vậy: CTHH cần tìm là Fe3O4.
b, BTNT C, có: nCaCO3 = nCO2 = 0,6 (mol)
⇒ mCaCO3 = 0,6.100 = 60 (g)
nung 37,6 gam một muối của kim loại X sau phản ứng kết thúc thu được m gam chất rắn Y là oxit bazơ của kim loại X. (trong Oxit X chiếm 80% về khối lượng) và 11,2 lít hỗn hợp khí Z gồm NO2 và O2 ở ĐKTC có tỉ khối so với H2 là 21,6.
a. Tính m
b. Xác định CTHH của X và Y
Hợp chất A là oxit của kim loại M Hoá trị 2 . Biết 0,2 mol axit A có khối lượng là 11,2 g . Nguyên tố M là
Gọi M là hóa trị 2
M MO=\(\dfrac{11,2}{0,2}=56g\ mol\)
M M=56-16 =40 g\mol
M là nguyên tố Canxi (Ca)
Bạn kiểm tra đề bài giúp mình!
Có thể bạn tìm:
"Đề: Hợp chất A là oxit của kim loại M hoá trị II. Biết 0,2 mol oxit A có khối lượng là 11,2 g. Nguyên tố M là:
Giải: Gọi công thức oxit A là MO.
Phân tử khối của A là 11,2/0,2=56 (g/mol) \(\Rightarrow\) M là canxi (Ca).".
Nhiệt phân hoàn toàn một lượng M(NO3)2 trong chân không (với M là kim loại) thu được 8 gam một oxit kim loại và 5,04 lít hỗn hợp khi X gồm NO2 và O2 (đo ở đktc). Khối lượng của hỗn hợp X là 10 gam. Kim loại M là
A. Mg.
B. Cu.
C. Fe.
D. Zn.
1.Oxit cao nhất của 1 nguyên tố R có dạng R2Ox. Phân tử khối của oxit là 102 đvC. Xác định R.
2. Cho biết phân tử khối của một oxit kim loại là 160, phần trăm khối lượng của kim loại trong
oxit là 70%. Lập công thức oxit đó.
1)
PTKR2Ox = 2.NTKR + 16x = 102 (đvC)
| x | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| NTKR | 43(Loại) | 35(Loại) | 27(Al) | 19(Loại) | 11(Loại) | 3(Loại) | Loại | Loại |
=> R là Al
2)
CTHH: RxOy
\(\%R=\dfrac{x.NTK_R}{160}.100\%=70\%\)
=> \(NTK_R=\dfrac{112}{x}\left(đvC\right)\)
Chỉ có x = 2 thỏa mãn \(NTK_R=\dfrac{112}{2}=56\left(đvC\right)\)
=> R là Fe
PTKFe2Oy = 160 (đvC)
=> y = 3
CTHH: Fe2O3
Lập công thức hóa học của một oxit kim loại, biết khối lượng mol của oxit là 94 gam, % khối lượng kim loại trong oxit là 82,98%.
Gọi CTHH của oxit kim loại là RxOy
Ta có:\(m_O=94.\left(100\%-82,98\%\right)=16\left(g\right)\Rightarrow y=\dfrac{16}{16}=1\)
\(\Rightarrow m_R=94-16=78\left(g\right)\)
\(\Rightarrow M_R=\dfrac{78}{x}\left(đvC\right)\)
Vì R là kim loại nên có hóa trị l,ll,lll
| x | l | ll | lll |
| MR | 78 | 39 | 26 |
| Kết luận | loại | thỏa mãn | loại |
⇒ R là kali (K)
Vậy CTHH là K2O
Nguyên tố R tạo một oxit RO2 (chất D) và một hợp chất RHn (chất E). Cho biết khối lượng riêng hơi của E ở dktc là 1,5179g/ml và phân tử khối của D là 32/17 phân tử khối của E.
a) Tìm nguyên tố R
b) M là kim loại hóa trị I, tạo được muối X có công thức M2RO3. Hòa tan 12,6g X trong 100ml dd HCl lấy dư có D = 1,2g/ml. Sau phản ứng thu được 126,2g dd. Tìm kim loại M
a) MD = R + 32 (g/mol)
ME = R + n (g/mol)
Theo đề bài \(\dfrac{M_D}{M_E}\)= \(\dfrac{R+32}{R+n}\)= \(\dfrac{32}{17}\) => \(\left\{{}\begin{matrix}n=2\\R=32\end{matrix}\right.\) là giá trị thỏa mãn
Vậy R là lưu huỳnh (S)
b) m 100ml dung dịch HCl = 1,2.100 = 120 gam
M2SO3 + 2HCl → 2MCl + SO2↑ + H2O
m dung dịch sau phản ứng = m M2SO3 + m dung dịch HCl - m SO2 = 126,2 gam
=> 12,6 + 120 - 126,2 = mSO2
<=> mSO2 = 6,4 gam , nSO2 = 6,4 : 64 = 0,1 mol
Theo phương trình phản ứng , nM2SO3 = nSO2 = 0,1 mol
=> MM2SO3 = \(\dfrac{12,6}{0,1}\)= 126 (g/mol)
=> MM = (126 - 32 - 16.3) : 2 = 23 g/mol
Vậy M là natri (Na)
Cho 3,64 gam hỗn hợp E gồm một oxit, một hiđroxit và một muối cacbonat trung hòa của một kim loại M có hóa trị II tác dụng vừa đủ với 117,6 gam dung dịch H2SO4 10%. Sau phản ứng, thu được 0,448 lít khí (đktc) và dung dịch muối duy nhất có nồng độ 10,867% (khối lượng riêng là 1,093 gam/ml); nồng độ mol là 0,545M.
a) Viết các phương trình phản ứng xảy ra và xác định kim loại M.
b) Tính % khối lượng của các chất có trong hỗn hợp E.
a) Đặt số mol của MO, M(OH)2, MCO3 tương ứng là x, y, z.
Nếu tạo muối trung hòa ta có các phản ứng:
MO + H2SO4 →MSO4 + H2O (1)
M(OH)2 + H2SO4 →MSO4 + 2H2O (2)
MCO3 + H2SO4 →MSO4 + H2O + CO2 (3)
Nếu tạo muối axít ta có các phản ứng:
MO + 2H2SO4 →M(HSO4)2 + H2O (4)
M(OH)2 + 2H2SO4 →M(HSO4)2 + 2H2O (5)
MCO3 + 2H2SO4 →M(HSO4)2 + H2O + CO2 (6)
Ta có :
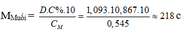
– TH1: Nếu muối là MSO4 M + 96 = 218 M = 122 (loại)
– TH2: Nếu là muối M(HSO4)2 M + 97.2 = 218 M = 24 (Mg)
Vậy xảy ra phản ứng (4, 5, 6) tạo muối Mg(HSO4)2
b) Theo (4, 5, 6) Số mol CO2 = 0,448/22,4 = 0,02 molz = 0,02 (I)
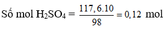
2x + 2y + 2z = 0,12 (II)
Đề bài: 40x + 58y + 84z = 3,64 (III)
Giải hệ (I, II, III): x = 0,02; y = 0,02; z = 0,02
%MgO = 40.0,02.100/3,64 = 21,98%
%Mg(OH)2 = 58.0,02.100/3,64 = 31,87%
%MgCO3 = 84.0,02.100/3,64 = 46,15%