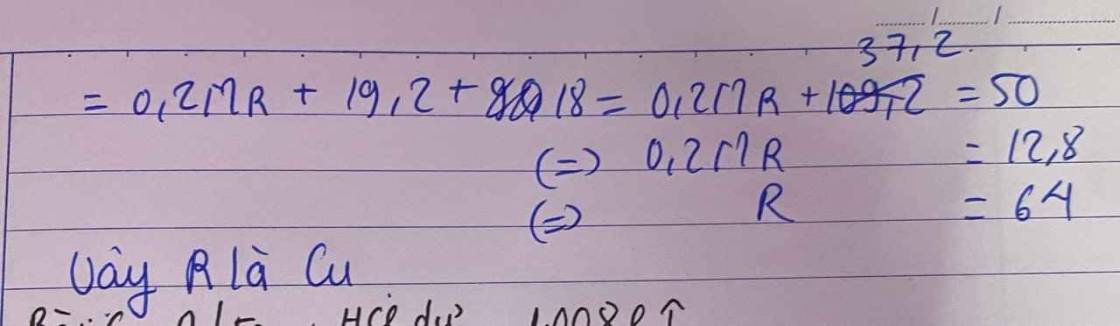cho 9,6g một kim loại hóa trị II vào dd H2SO4 đặc nóng thấy thu được 24g muối. Xác định kim loại
NA
Những câu hỏi liên quan
Hòa tan 1oxit kim loại hóa trị II bằng lượng vừa đủ H2SO4 10% thu được dd muối có nồng độ 11.77%. Xác định tên?
Hòa tan 1oxit kim loại hóa trị II bằng lượng vừa đủ H2SO4 10% thu được dd muối có nồng độ 11.77%. Xác định tên oxit kim loại.AO + H2SO4 ---> ASO4 + H2O
1mol..1mol..........1mol
theo bảo toàn khối lượng ta có
m dd = m AO + m H2SO4
= 16 + A + 98.100/10= 996 + A(g)
m ASO4 = 96 + A
=> pt
(96 + A)/(996 + A)= 11,77%
=> A = 24 ( Mg)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn muối sunfua của 1 kim loiaj hóa trị II thu được khí A và rắn B cho A hấp thụ hoàn toàn vào 200ml dd NaOH 1,5M rồi đem cô cạn dd thu được 23g muối.
-Nếu đem B hòa tan bằng H2SO4 loãng rồi cô cạn dd thì được 50g MSO4.5H2O. Xác định kim loại hóa trị II
cho 32,05g hỗn hợp gồm kim loại Zn và một kim loại A hóa trị II
TN1: cho hh kim loại phản ứng với H2SO4 loãng dư thu được 4,48 lít khí đktc
TN2/; cho hh kim loại pứ với H2SO4 đặc, nóng thu được 11,2 lít khí đktc
Xác định tên kim loại A và thành phần phần trăm mỗi kim loại trong hỗn hợp
cho 32,05 gam hỗn hợp gồm kim loại Zn và một kim loại A hóa trị II.
TN1: cho hh hợp kim loại phản ứng với H2SO4 loãng, dư thu được 4,48 lít khí đktc.
TN2: cho hh kim loại phản ứng với H2SO4 đặc, nóng thu được 11,2 lít khí đktc
Xác định kim loại A và thành phần phần trăm khối lượng mỗi kim loại trong hh.
cho 19,2 g kim loại M hóa trị 2 tác dụng vừa đủ với dd h2so4 đặc nóng thu được dd x và khí so2 duy nhất .dẫn toàn bộ khí so2 thu được td với 1 lít dd naoh 0,7M thu được dd y cô cạn dd y thu được 41,8 gam chất rắn .xác định kim loại M
Hòa tan hoàn toàn a ( mol) một kim loại M hóa trị II vào một lượng dd H2SO4 vừa đủ 20% thu được dd A có nồng độ 22,64%
1/ Tính khối lượng dd H2SO4 theo a
2/ Tính khối lượng dd sau phản ứng theo a , M
3/ Xác định công thức oxit kim loại M
\(M+H_2SO_4\rightarrow MSO_4+H_2\uparrow\\ n_{ASO_4}=n_A=n_{H_2}=n_{H_2SO_4}=a\left(mol\right)\\ 1.m_{ddH_2SO_4}=\dfrac{98a.100}{20}=490a\left(g\right)\\ 2.m_{ddsau}=M_M.a+490a-2a=\left(M_M+488\right).a\left(g\right)\\ C\%_{ddsau}=22,64\%\\ \Leftrightarrow\dfrac{\left(M_M+96\right)a}{\left(M_M+488\right)a}.100\%=22,64\%\\ \Leftrightarrow M_M=18,72\left(loại\right)\)
Khả năng cao sai đề nhưng làm tốt a,b nha
Đúng 0
Bình luận (0)
Jòa tan hoàn toàn 12,6g muối carbonate kim loại hóa trị II (RCO3) bằng 150 ml dd HCl (d=1,08g/ml), sau phản ứng thu được ddA và 3,7185 lít khí (đkc).
a. Xác định kim loại R.
b. Tính nồng độ phần trăm muối trong dd A.
c. Cho dd AgNO3 dư vào dd A thu được 53,8125 g kết tủa. Tính nồng độ mol/lít của dd HCl đem dùng.
\(m_{dd.HCl}=1,08.150=162\left(g\right)\)
\(n_{CO_2}=\dfrac{3,7185}{24,79}=0,15\left(mol\right)\)
\(RCO_3+2HCl\rightarrow RCl_2+H_2O+CO_2\)
0,15<----------------0,15<-----------0,15
Có: \(R+60=\dfrac{12,6}{0,15}\Rightarrow R=24\left(g/mol\right)\)
a. Kim loại R là Magie (Mg)
b. \(C\%_{MgCl_2}=\dfrac{0,15.95.100\%}{12,6+162-0,15.44}=8,48\%\)
c. \(n_{AgCl}=\dfrac{53,8125}{143,5}=0,375\left(mol\right)\)
\(MgCl_2+2AgNO_3\rightarrow2AgCl+Mg\left(NO_3\right)_2\)
0,15-------------------->0,3
Vì \(n_{AgCl}=0,3\left(mol\right)< 0,375\left(mol\right)_{theo.đề}\) \(\Rightarrow\) HCl dư
\(HCl+AgNO_3\rightarrow AgCl+HNO_3\)
0,075<------------0,075
\(CM_{HCl.đem.dùng}=\dfrac{0,075}{0,15}=0,5M\)
Đúng 1
Bình luận (0)
Hòa tan hoang toàn 13g một kim loại M hóa trị II vào axit H2SO4 đặc, nóng thu được 4,48l khí SO2 (đktc). Kim loại thu được là A. Mg B. Zn C. Cu D. Fe
Ta có: \(n_{SO4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ M_M=\dfrac{18}{0,2}=65\)
Vậy kim loại cần tìm là Zn
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 4.8g kim loại M có há trị 2 bằng dd h2so4 đặc nóng thu được 1.68 l so2 . Xác định tên kim loại M
M + 2H2SO4 => MSO4 + SO2 + 2H20
nSO2 = 1.68/22.4 = 0.075 MOL
=> nKIM LOẠI M = 0.075 mol
M của Kl M = m/n = 4.8/0.075 = 64 => Cu
Đúng 1
Bình luận (0)
nSO2 = 1.68 / 22.4 = 0.075 (mol)
M + 2H2SO4(đ) => MSO4 + SO2 + 2H2O
0.075....................................0.075
MM = 4.8 / 0.075 = 64
=> M là : Cu
Đúng 0
Bình luận (0)