Tính số mol của MgCl2 trong 400g dd MgCl2 0,4M có d = 1,2 g/mol
DT
Những câu hỏi liên quan
Hãy tính nồng độ mol của mỗi dung dịch sau:
a) 1 mol KCl trong 750ml dung dịch.
b) 0,5 mol MgCl2 trong 1,5 lít dung dịch.
c) 400g CuSO4 trong 4 lít dung dịch.
d) 0,06 mol Na2CO3 trong 1500ml dung dịch.
Tính nồng độ mol của các dung dịch:
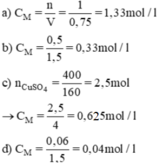
Đúng 2
Bình luận (0)
Tính nồng độ phần trăm của những dung dịch sau:
d, 0,2 mol MgCl2 trong 400g dung dịch
Ta có: \(m_{MgCl_2}=0,2.95=19\left(g\right)\)
\(\Rightarrow C\%_{MgCl_2}=\dfrac{19}{400}.100\%=4,75\%\)
Đúng 4
Bình luận (0)
Tính khối lượng, số mol của MgCl2 có trong 300 gam dung dịch MgCl2 9,5% ?
\(m_{MgCl_2}=300\cdot9.5\%=28.5\left(g\right)\)
\(n_{MgCl_2}=\dfrac{28.5}{95}=0.3\left(mol\right)\)
Đúng 3
Bình luận (1)
C%= \(\dfrac{m_{ct}}{m_{dd}}\) . 100 %
Ta có : \(m_{MgCl2}=\) 9,5%.300=28,5 (gam)
=>\(n_{MgCl_2}\) =28,5:(24+2.35,5)= 0,3 ( mol )
Đúng 1
Bình luận (0)
Cho4.8g Mg tacs dungj vs 200g HCL. Thu đc muối MGCL2 và h2
a. tính Thể tích khí H2 thu được (đktc)
b. Tính nồng độ mol của dd HCl cần dùng
c. Tính khối lượng MgCl2 thu được.
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
0,2 0,4 0,2 0,2
a) \(n_{H2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
Câu b : hình như đề bị sai bạn xem lại giúp mình
c) \(n_{MgCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{MgCl2}=0,2.95=19\left(g\right)\)
Chúc bạn học tốt
Đúng 1
Bình luận (0)
n\(_{H2}\)=\(\dfrac{4,8}{24}=0,2\left(mol\right)\)
Mg + 2HCl \(\rightarrow\)MgCl2 + H2
0,2 \(\rightarrow\) 0,4 \(\rightarrow\) 0,2 \(\rightarrow\) 0,2
a) VH2 = 0,2 . 22,4
=4,48 (l )
c) mMgCl2 = n.M = 0,2.95 = 19 (g)
Đúng 1
Bình luận (0)
Hòa tan hết hỗn hợp X gồm Mg và KL M bằng một lượng vừa đủ dd HCl 20%, sau pứ thu dược một dd Y trong đó nồng độ phần trăm của MgCl2 là 5,78%.Biết trong hỗn hợp số mol M gấp 3 lần số mol Mg. tìm M và tính C% của muối thứ 2 trong X.
Cái bài này cũng hok khó đâu. Chỉ có đều là số lẻ, tính toán rất dễ nhầm thôi.
Gọi a, b là số mol Fe và Mg.
Viết 2 ptpứ của Fe và Mg ra
==> ta có: - n HCl =2a + 2b =>m ddHCl ban đầu=365(a+b).
- Khối lượng H2 thoát ra =2a+2b
Ta có: %FeCl2=0.1576 ==> 127a/(mddHCl ban đầu+mFe+mMg-mH2) =0.1576
<=> ... <=> 127a/(419a+387b)=0.1576 ==> tỉ lệ a:b ~ 1
Vậy %MgCl2=95b/(419a+387b)=95/(419+387) ~ 11.79%
Đúng 0
Bình luận (2)
Hạo copy Tính nồng độ phần trăm muối Fe trong dung dịch? | Yahoo Hỏi & Đáp
Lớp 8 trở xuống mà nói hòa k khó đâu
kkkkkkkkkkk
Đúng 0
Bình luận (0)
hãy tính nồng độ mol của dung dịch sau: 0,5 mol MgCl 2 trong 1,5 lít dung dịch
Hòa Tan hoàn toàn 7,2 g kim loại Mg vào 200 ml dd axit clohidric ( HCL ) sau phản ứng thu được magie clorua MgCl2 và khí hidro ( đktc )
a viết PTHH
b tính khối lượng magie clorua tạo thành
c tính nồng độ mol của dd axit đã dùng
a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
b, \(m_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
Theo PT: \(n_{MgCl_2}=n_{Mg}=0,3\left(mol\right)\Rightarrow m_{MgCl_2}=0,3.95=28,5\left(g\right)\)
c, \(n_{HCl}=2n_{Mg}=0,6\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{0,6}{0,2}=3\left(M\right)\)
Đúng 2
Bình luận (0)
trộn 100ml dd MgCl2 2M với 150ml dd KOH 2M, thấy xuất hiện kết tủa màu tắng. Lọc bỏ kết tủa thu được một dd. Tính nồng độ mol của các chất trong dd thu được,biết dự pha trộn không làm thay đổi thế tích dd
nMgCL2=0.2(mol)
nKOH=0.3(mol)
MgCL2+2KOH->Mg(OH)2+2KCl
0.2 0.3
->MgCl dư
nMg(OH)2=0.15(mol)CM=0.6(M)
nKCl=0.3(mol)CM=1.2(M)
nMgCl dư=0.2-0.3:2=0.05(mol)CM=0.2(M)
Đúng 0
Bình luận (0)
TRÔn 75gam dd KOH 5,6% với 50 gam dd MgCl2 9,5%
a,tính khối lượng kết tủa thị dược
b, tính nồng đọ mol và nồng độ phằn trăm của dd thu dược
mKOH=4,2g
=> nKOH=0,075mol
mMgCl2=4,75g
=> nMgCl2=0,05mol
pthh:2 KOH+MgCl2=>Mg(OH)2+2KCl
0,075: 0,05
0,075->0,0375->0,0375->0,075
mMg(OH)2=0,0375.58=2,175g
Đúng 0
Bình luận (0)





