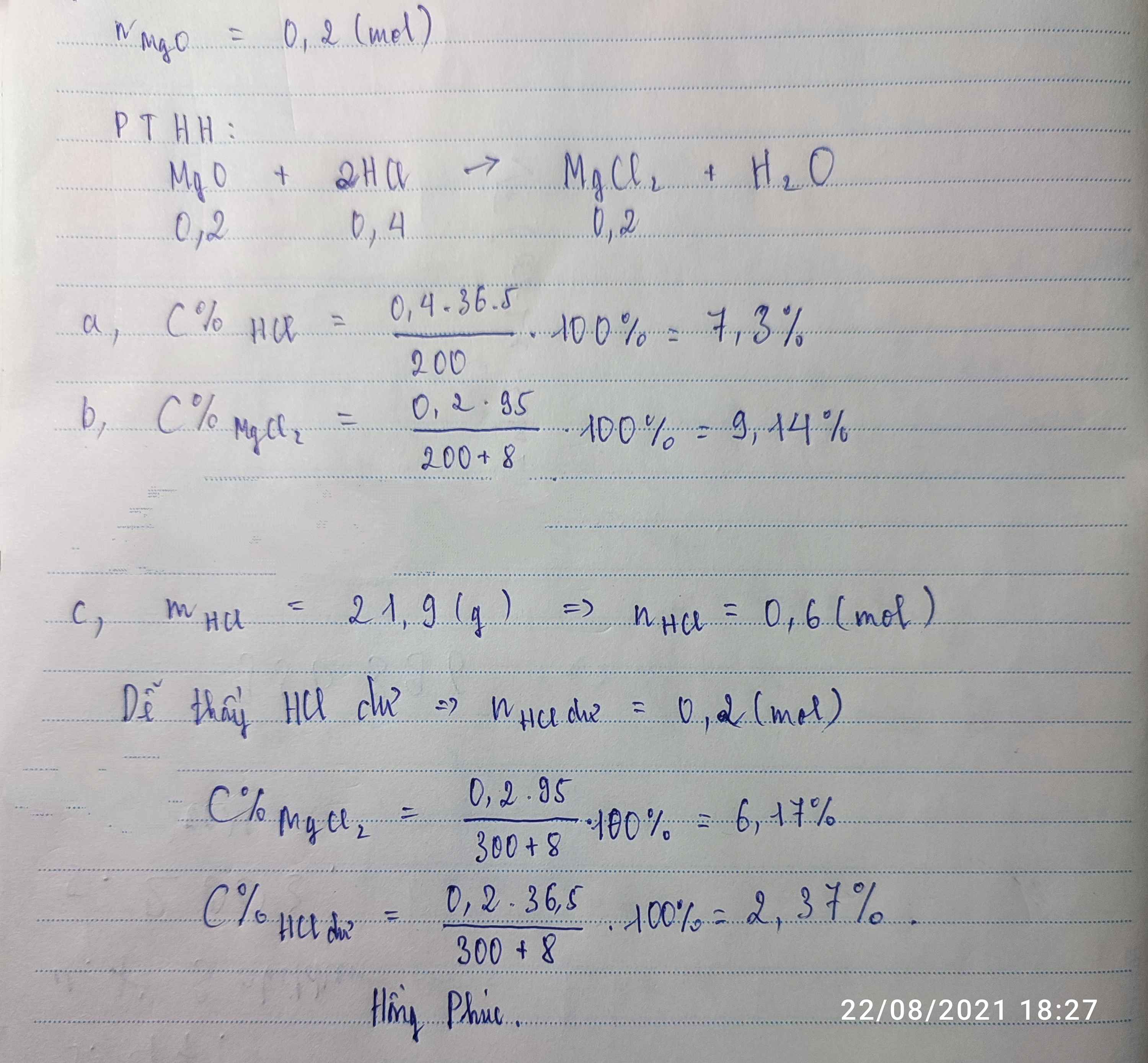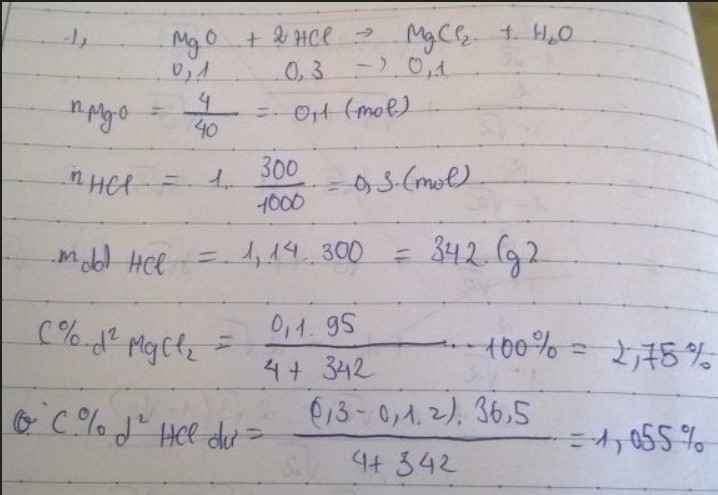Hòa tan 6.8g MgO vào trong 100g dung dịch HCl 14.6% tính C%của dung dịch sau phản ứng
NA
Những câu hỏi liên quan
Hòa tan hoàn toàn 8g MgO vào 200 g dd HCl vừa đủ tạo dd A.a)Tính C% của dd HCl đã dùng. b)Tính C% của dd tạo thành sau phản ứng.c)Nếu đem hòa tan lượng MgO ở trên trong 300g dung dịch HCl 7,3%. Tìm C% của các chất có trong dung dịch A.Hòa tan hoàn toàn 8g MgO vào 200 g dd HCl vừa đủ tạo dd A.a)Tính C% của dd HCl đã dùng. b)Tính C% của dd tạo thành sau phản ứng.c)Nếu đem hòa tan lượng MgO ở trên trong 300g dung dịch HCl 7,3%. Tìm C% của các chất có trong dung dịch A.
Đọc tiếp
Hòa tan hoàn toàn 8g MgO vào 200 g dd HCl vừa đủ tạo dd A.
a)Tính C% của dd HCl đã dùng. b)Tính C% của dd tạo thành sau phản ứng.
c)Nếu đem hòa tan lượng MgO ở trên trong 300g dung dịch HCl 7,3%. Tìm C% của các chất có trong dung dịch A.Hòa tan hoàn toàn 8g MgO vào 200 g dd HCl vừa đủ tạo dd A.
a)Tính C% của dd HCl đã dùng. b)Tính C% của dd tạo thành sau phản ứng.
c)Nếu đem hòa tan lượng MgO ở trên trong 300g dung dịch HCl 7,3%. Tìm C% của các chất có trong dung dịch A.
hòa tan 0,02 mol Mg vào 100g dung dịch HCl 36,5%, đến khi phản ứng sảy ra hoàn toàn thu được dung dịch A và khí H2. tính C% của dung dịch A
\(n_{HCl}=\dfrac{100.36,5\%}{100\%}:36,5=1\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,02-->0,04----->0,02---->0,02
Xét: \(\dfrac{0,02}{1}< \dfrac{1}{2}\) => HCl dư
A gồm \(\left\{{}\begin{matrix}n_{HCl}=1-0,04=0,06\left(mol\right)\\n_{MgCl_2}=0,02\left(mol\right)\end{matrix}\right.\)
\(m_{dd.A}=0,02.24+100-0,02.2=100,44\left(g\right)\)
\(C\%_{HCl}=\dfrac{0,06.36,5.100\%}{100,44}=2,18\%\)
\(C\%_{MgCl_2}=\dfrac{0,02.95.100\%}{100,44}=1,89\%\)
Đúng 1
Bình luận (0)
Hòa tan 1,5g MgO vào 100g dung dịch HCl 5,475%
a) Viết phương trình.
b) Tính nồng độ % của các chất có trong dung dịch sau phản ứng.
Xem chi tiết
\(n_{MgO}=\frac{1,5}{40}=0,0375\left(mol\right)\)
\(n_{HCl}=\frac{100.5,475}{100.36,5}=0,15\left(mol\right)\)
\(PTHH:MgO+2HCl\rightarrow MgCl_2+H_2O\)
(mol)____0,0375__0,075____0,0375_________
Tỉ lệ: \(\frac{0,15}{2}>\frac{0,0375}{1}\rightarrow\) HCl dư 0,15 - 0,075 = 0,075(mol)
\(C\%_{\text{dd}MgCl_2}=\frac{0,0375.95}{1,5+100}.100\%=3,51\left(\%\right)\)
\(C\%_{HCl.du}=\frac{36,5.0,075}{1,5+100}.100\%=2,7\left(\%\right)\)
Câu 4(3 điểm) Hòa tan 9,2g hỗn hợp gồm: Mg và MgO vào dung dịch HCl 14,6% vừa đủ. Sau phản ứng thu được 1,12 lít khí ở đktc.
a)Viết PTHH
b)Tính khối lượng Mg và MgO trong hỗn hợp đầu.
c)Tính khối lượng dung dịch axit HCl 14,6% đã dùng.
( Cho Mg = 24; Cl= 35,5; H = 1; O = 16;)
Câu 4 :
\(n_{H2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
a) Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
0,05 0,1 0,05
\(MgO+2HCl\rightarrow MgCl_2+H_2O|\)
1 2 1 1
0,2 0,4
b) \(n_{Mg}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
\(m_{Mg}=0,05.24=1.2\left(g\right)\)
\(m_{MgO}=9,2-1,2=8\left(g\right)\)
c) Có : \(m_{MgO}=8\left(g\right)\)
\(n_{MgO}=\dfrac{8}{40}=0,2\left(mol\right)\)
\(n_{HCl\left(tổng\right)}=0,1+0,4=0,5\left(mol\right)\)
\(m_{HCl}=0,05.36,5=18,25\left(g\right)\)
\(m_{ddHCl}=\dfrac{18,25.100}{14,6}=125\left(g\right)\)
Chúc bạn học tốt
Đúng 2
Bình luận (1)
Câu 1 . Lấy 8,4g Mg hòa tan vào 146g dung dịch HCl thì vừa đủa,Viết pt phản ứngb,Tính nồng độ phần trăm của dung dịch HCl đầuc,Tính nồng độ phần trăm các chất trong dung dịch sau phản ứng Câu 2. Hòa tan 10g CaCO3 vào 114,1g dung dịch HCl 8%a,Viết pt pư b,Tính nồng độ % các chất thu được sau PƯ Câu 3. Cho a(g) Fe tác dụng vừa đủ 150ml dung dịch HCl ( D1,2g/ml) thu được dung dịch và 6,72 lít khí ( đktc)a, Viết pt pưb,Tính nồng độ % và nồng độ mol/l dung dịch HCl
Đọc tiếp
Câu 1 . Lấy 8,4g Mg hòa tan vào 146g dung dịch HCl thì vừa đủ
a,Viết pt phản ứng
b,Tính nồng độ phần trăm của dung dịch HCl đầu
c,Tính nồng độ phần trăm các chất trong dung dịch sau phản ứng
Câu 2. Hòa tan 10g CaCO3 vào 114,1g dung dịch HCl 8%
a,Viết pt pư
b,Tính nồng độ % các chất thu được sau PƯ
Câu 3. Cho a(g) Fe tác dụng vừa đủ 150ml dung dịch HCl ( D=1,2g/ml) thu được dung dịch và 6,72 lít khí ( đktc)
a, Viết pt pư
b,Tính nồng độ % và nồng độ mol/l dung dịch HCl
Câu 1 :
\(n_{Mg}=\dfrac{8.4}{24}=0.35\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(0.35.......0.7.........0.35..........0.35\)
\(C\%_{HCl}=\dfrac{0.7\cdot36.5}{146}\cdot100\%=17.5\%\)
\(m_{\text{dung dịch sau phản ứng}}=8.4+146-0.35\cdot2=153.7\left(g\right)\)
\(C\%_{MgCl_2}=\dfrac{0.35\cdot95}{153.7}\cdot100\%=21.6\%\)
Đúng 3
Bình luận (3)
Câu 2 :
\(n_{CaCO_3}=\dfrac{10}{100}=0.1\left(mol\right)\)
\(n_{HCl}=\dfrac{114.1\cdot8\%}{36.5}=0.25\left(mol\right)\)
\(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
\(1................2\)
\(0.1.............0.25\)
\(LTL:\dfrac{0.1}{1}< \dfrac{0.25}{2}\Rightarrow HCldư\)
\(m_{\text{dung dịch sau phản ứng}}=10+114.1-0.1\cdot44=119.7\left(g\right)\)
\(C\%_{HCl\left(dư\right)}=\dfrac{\left(0.25-0.2\right)\cdot36.5}{119.7}\cdot100\%=1.52\%\)
\(C\%_{CaCl_2}=\dfrac{0.2\cdot111}{119.7}\cdot100\%=18.54\%\)
Đúng 5
Bình luận (1)
Câu 3 :
\(n_{H_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.3.......0.6......................0.3\)
\(m_{Fe}=0.3\cdot56=16.8\left(g\right)\)
\(m_{dd_{HCl}}=150\cdot1.2=180\left(g\right)\)
\(C\%_{HCl}=\dfrac{0.6\cdot36.5}{180}\cdot100\%=12.16\%\)
\(C_{M_{HCl}}=\dfrac{0.6}{0.15}=4\left(M\right)\)
Đúng 3
Bình luận (0)
Bài 4. (3đ) Hòa tan hoàn toàn 4 gam MgO vào 300ml dung dịch HCl 1M.
1/ Viết phương trình hóa học xảy ra
2/ Tính nồng độ phần phần trăm(C %) của các chất có trong dung dịch sau khi phản ứng kết thúc. (Biết khối lượng riêng của dd HCl là D = 1,14g/ml)
Bài 4 :
\(n_{MgO}=\dfrac{4}{40}=0,1\left(mol\right)\)
300ml = 0,3l
\(n_{HCl}=1.0,3=0,3\left(mol\right)\)
1) Pt : \(MgO+2HCl\rightarrow MgCl_2+H_2O|\)
1 2 1 1
0,1 0,3 0,1
2) Lập tỉ số so sánh : \(\dfrac{0,1}{1}< \dfrac{0,3}{2}\)
⇒ MgO phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của MgO
\(n_{MgCl2}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
⇒ \(m_{MgCl2}=0,1.95=9,5\left(g\right)\)
\(n_{HCl\left(dư\right)}=0,3-\left(0,1.2\right)=0,1\left(mol\right)\)
⇒ \(m_{HCl\left(dư\right)}=0,1.36,5=3,65\left(g\right)\)
\(m_{ddHCl}=1,14.300=342\left(g\right)\)
\(m_{ddspu}=4+342=346\left(g\right)\)
\(C_{MgCl2}=\dfrac{9,5.100}{346}=2,75\)0/0
\(C_{HCl\left(dư\right)}=\dfrac{3,65.100}{346}=1,05\)0/0
Chúc bạn học tốt
Đúng 0
Bình luận (0)
1. Hòa tan hoàn toàn 2,8 gam hỗn hợp gồm Fe2O3, MgO, CuO cần dùng 200 ml HCl 0,5M, sau phản ứng thu được m gam hỗn hợp muối Chloride. Tính m.2. Cho 200g dung dịch KOH 5,6% vào dung dịch CuCl2 dư. Tính khối lượng của base không tan sau phản ứng thu được. 3. Để có được dung dịch NaCl 32%, thì khối lượng NaCl cần lấy hoà tan vào 200 gam nước là bao nhiêu? 4. Người ta nung 15 g CaCO3 thu được 6,72 g CaO và một lượng khí CO2. Tính hiệu suất phản ứng.
Đọc tiếp
1. Hòa tan hoàn toàn 2,8 gam hỗn hợp gồm Fe2O3, MgO, CuO cần dùng 200 ml HCl 0,5M, sau phản ứng thu được m gam hỗn hợp muối Chloride. Tính m.
2. Cho 200g dung dịch KOH 5,6% vào dung dịch CuCl2 dư. Tính khối lượng của base không tan sau phản ứng thu được.
3. Để có được dung dịch NaCl 32%, thì khối lượng NaCl cần lấy hoà tan vào 200 gam nước là bao nhiêu?
4. Người ta nung 15 g CaCO3 thu được 6,72 g CaO và một lượng khí CO2. Tính hiệu suất phản ứng.
Bài 1:
Ta có: \(n_{HCl}=0,2.0,5=0,1\left(mol\right)\)
BTNT H, có: \(n_{HCl}=2n_{H_2O}\Rightarrow n_{H_2O}=0,05\left(mol\right)\)
Theo ĐL BTKL, có: m oxit + mHCl = mmuối + mH2O
⇒ mmuối = 2,8 + 0,1.36,5 - 0,05.18 = 5,55 (g)
Đúng 3
Bình luận (0)
Bài 2:
\(m_{KOH}=200.5,6\%=11,2\left(g\right)\Rightarrow n_{KOH}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PT: \(2KOH+CuCl_2\rightarrow2KCl+Cu\left(OH\right)_2\)
Theo PT: \(n_{Cu\left(OH\right)_2}=\dfrac{1}{2}n_{KOH}=0,1\left(mol\right)\)
\(\Rightarrow m_{Cu\left(OH\right)_2}=0,1.98=9,8\left(g\right)\)
Đúng 3
Bình luận (0)
Bài 3:
Ta có: \(C\%_{NaCl}=\dfrac{m_{NaCl}}{m_{NaCl}+m_{H_2O}}.100\%=32\%\)
\(\Rightarrow\dfrac{m_{NaCl}}{m_{NaCl}+200}=0,32\)
\(\Rightarrow m_{NaCl}\approx94,12\left(g\right)\)
Bài 4:
Ta có: \(n_{CaCO_3}=\dfrac{15}{100}=0,15\left(mol\right)\)
PT: \(CaCO_3\underrightarrow{t^o}CaO+CO_2\)
Theo PT: \(n_{CaO\left(LT\right)}=n_{CaCO_3}=0,15\left(mol\right)\)
\(\Rightarrow m_{CaO\left(LT\right)}=0,15.56=8,4\left(g\right)\)
\(\Rightarrow H=\dfrac{6,72}{8,4}.100\%=80\%\)
Đúng 3
Bình luận (0)
Câu 1: Hòa tan 9,2g hỗn hợp gồm: Mg và MgO vào dung dịch HCl 14,6% vừa đủ. Sau phản ứng thu được 1,12 lít khí ở đktc.
a)Viết PTHH
b)Tính khối lượng Mg và MgO trong hỗn hợp đầu.
c)Tính khối lượng dung dịch axit HCl 14,6% đã dùng.( Cho Mg = 24; Cl= 35,5; H = 1; O = 16;)
Câu 1: Hòa tan 9,2g hỗn hợp gồm: Mg và MgO vào dung dịch HCl 14,6% vừa đủ. Sau phản ứng thu được 1,12 lít khí ở đktc.a)Viết PTHHb)Tính khối lượng Mg và MgO trong hỗn hợp đầu.c)Tính khối lượng dung dịch axit HCl 14,6% đã dùng.( Cho Mg 24; Cl 35,5; H 1; O 16;)Câu 2: Hòa tan hoàn toàn 21 gam hỗn hợp CuO và Zn vào dd H2SO4 0,5M thu được 4,48 lit khí thoát ra ở đktc.a) Viết các phương trình phản ứng xảy ra?b) Tính tỉ lệ % theo khối lượng các chất rắn có trong hỗn hợp đầu?c) Tính thể t...
Đọc tiếp
Câu 1: Hòa tan 9,2g hỗn hợp gồm: Mg và MgO vào dung dịch HCl 14,6% vừa đủ. Sau phản ứng thu được 1,12 lít khí ở đktc.
a)Viết PTHH
b)Tính khối lượng Mg và MgO trong hỗn hợp đầu.
c)Tính khối lượng dung dịch axit HCl 14,6% đã dùng.( Cho Mg = 24; Cl= 35,5; H = 1; O = 16;)
Câu 2: Hòa tan hoàn toàn 21 gam hỗn hợp CuO và Zn vào dd H2SO4 0,5M thu được 4,48 lit khí thoát ra ở đktc.
a) Viết các phương trình phản ứng xảy ra?
b) Tính tỉ lệ % theo khối lượng các chất rắn có trong hỗn hợp đầu?
c) Tính thể tích dd H2SO4 đã dùng? (Cho Cu =64, Zn =65, H =1, S =32, O =16)
Câu 3: Cho 80 gam dung dịch NaOH 10% tác dụng vừa đủ với dd MgSO4 10%.
a. Nêu hiện tượng và viết phương trình hóa học? Tính khối lượng chất rắn thu được ?
b. Tính khối lượng dd muối MgSO4 tham gia phản ứng ?
c. Tính nồng độ phần trăm dung dịch muối sau phản ứng
Câu 4: Cho 11,2 gam bột sắt tan vừa đủ trong dung dịch axit sunfuric 20% (khối lượng riêng của dung dịch là 1,2 gam/ml). Tính thể tích dung dịch axit sunfuric cần dùng?
Câu 5: Cho 400ml dd HCl 0,5 M tác dụng với 100 gam dd Ba(OH)2 16%. Tính khối lượng các chất sau phản ứng
MỌI NGƯỜI ƠI XIN GIÚP MÌNH VỚI