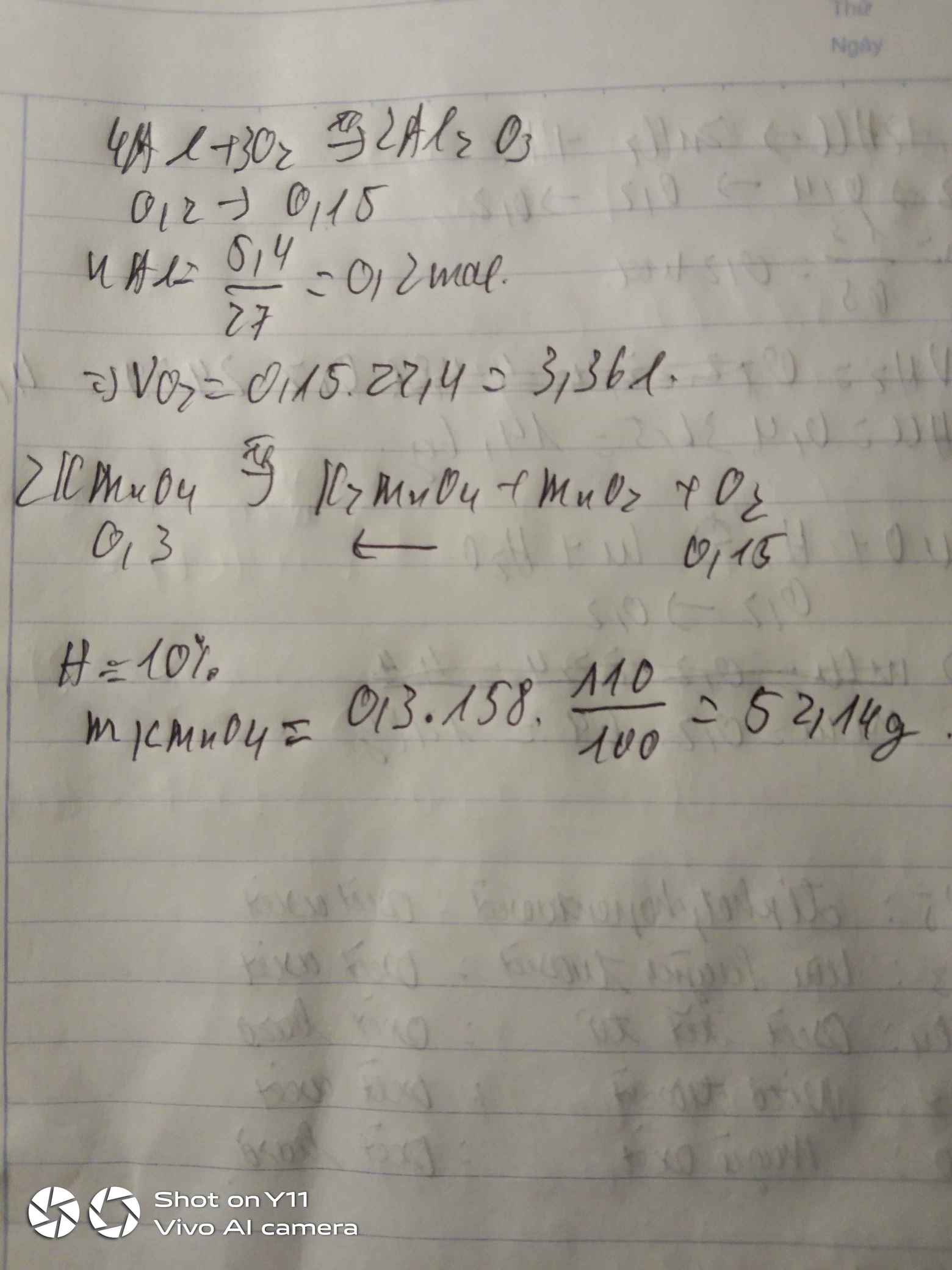đốt cháy 5,4g bột nhôm thì cần bao nhiêu ml khí o2 (dktc)
NH
Những câu hỏi liên quan
Cần bao nhiêu lít oxi (đktc) để đốt cháy hoàn toàn:
a, 5,4g bột nhôm?
b, 2,24 lít khí metan?
Xem chi tiết
\(a) 4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3\\ n_{O_2} = \dfrac{3}{4},n_{Al} = \dfrac{3}{4}.\dfrac{5,4}{27} = 0,15(mol)\\ V_{O_2} = 0,15.22,4 = 3,36(lít)\\ c)\ CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ V_{O_2} = 2V_{CH_4} = 2,24.2 = 4,48(lít)\)
Đúng 2
Bình luận (0)
\(a.\)
\(n_{Al}=\dfrac{5.4}{27}=0.2\left(mol\right)\)
\(4Al+3O_2\underrightarrow{t^0}2Al_2O_3\)
\(0.2.....0.15\)
\(V_{O_2}=0.15\cdot22.4=3.36\left(l\right)\)
\(b.\)
\(n_{CH_4}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(CH_4+2O_2\underrightarrow{t^0}CO_2+2H_2O\)
\(0.1.........0.2\)
\(V_{O_2}=0.2\cdot22.4=4.48\left(l\right)\)
Đúng 0
Bình luận (0)
a) nAl= 5,4/27=0,2(mol)
PTHH: 4 Al + 3 O2 -to-> 2 Al2O3
nO2= 3/4. 0,2= 0,15(mol)
->V(O2,đktc)=0,15 x 22,4=3,36(l)
b) nCH4=2,24/22,4=0,1(mol)
PTHH: CH4 + 2 O2 -to-> CO2 + 2 H2O
nO2=2. 0,1=0,2(mol)
=>V(O2,đktc)=0,2.22,4=4,48(l)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
đốt cháy 5,4g nhôm 2 trong bình chứa 2,24 lít khí O2 (ở đktc) a, tính khối lượng oxit tạo thành trong phản ứng trên b, tính khối lượng CLO3 cần dùng khí phân hủy thì thu được một thể tích khí O2 (ở dktc) bằng với thể tích khí O2 đã sử dụng ở phản ứng trên b cho biết:O=16; Al=27)
Đốt cháy vật Al kim loại trong ko khí thu đc nhôm oxit(Al2O3)
a. Viết PTHH
b. Nếu đốt cháy hết 4,05g bột Al thì thu đc bao nhiêu g Al2O3?
c. Để thu đc 25,5g Al2O3 thì cần đốt cháy hết bao nhiêu g Al và dùng ít nhất bao nhiêu lít khí O2
Xem chi tiết
\(\left(a\right)\)\(4Al+3O_2\underrightarrow{t^0}2Al_2O_3\)
\(\left(b\right)\)\(n_{Al}=\dfrac{4.05}{27}=0.15\left(mol\right)\)
\(\Rightarrow n_{O_2}=\dfrac{3}{4}n_{Al}=0.1125\left(mol\right)\Rightarrow V_{O_2}=2.52\left(l\right)\)
\(\Rightarrow n_{Al_2O_3}=\dfrac{n_{Al}}{2}=\dfrac{0.15}{2}=0.075\left(mol\right)\)
\(m_{Al_2O_3}=0.075\cdot102=7.65\left(g\right)\)
\(\left(c\right)\)
Để điều chế : 7.65 (g) Al2O3 thì cần 4.05 (g) Al và 2.52(l) khí O2
Vậy : để điều chế 25.5(g) Al2O3 thì cần x(g) Al và y(l) khí O2
\(m_{Al}=\dfrac{25.5\cdot4.05}{7.65}=13.5\left(g\right)\)
\(V_{O_2}=\dfrac{25.5\cdot2.52}{7.65}=8.4\left(l\right)\)
Đúng 2
Bình luận (0)
a) PTHH: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b) Ta có: \(n_{Al}=\dfrac{4,05}{27}=0,15\left(mol\right)\)
\(\Rightarrow n_{Al_2O_3}=0,075mol\) \(\Rightarrow m_{Al_2O_3}=0,075\cdot102=7,65\left(g\right)\)
c) Ta có: \(n_{Al_2O_3}=\dfrac{25,5}{102}=0,25\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,5mol\\n_{O_2}=0,375mol\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,5\cdot27=13,5\left(g\right)\\V_{O_2}=0,375\cdot22,4=8,4\left(l\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Đốt cháy vật Al kim loại trong ko khí thu được nhôm oxit(Al2O3)
a. Viết PTHH đó
b. Nếu đốt cháy hết 4,05g bột Al thì thu được bao nhiêu g Al2O3?
c. Để thu đc 25,5g Al2O3 thì cần đốt cháy hết bao nhiêu g Al và dùng ít nhất bao nhiêu lít O2
Xem chi tiết
a) PTHH : 4 Al + 3\(O_2\) ---> \(2Al_2O_3\)
b)
\(n_{Al_2O_3}\) = \(\dfrac{m}{M}\) = 0.15 (mol)
Có : \(n_{Al}\) = \(\dfrac{1}{2}n_{Al_2O_3}\) = 0.15 . \(\dfrac{1}{2}\) = 0.075 (mol)
=> \(m_{Al_2O_3}\) = n.M = 7.65 (g)
c) \(n_{Al_2O_3}\) = \(\dfrac{m}{M}\) = 0.25 (mol)
Có : \(n_{Al_2O_3}=2n_{Al}\)
-> \(n_{Al}\) = 0.5 (mol)
=> \(m_{Al}\) = n.M = 13.5 (g)
Có : \(n_{Al_2O_3}=\dfrac{3}{2}n_{O_2}\) = 0.375 (mol)
=> \(V_{O_2\left(đktc\right)}\) = n.22.4 = 8.4 (L)
Đúng 1
Bình luận (0)
a. PTHH: 4Al + 3O2 ---> 2Al2O3
0,15 mol 0,1125 mol 0,075 mol
b. + Số mol của Al:
nAl = m/M = 4,05/27 = 0,15 (mol)
+ Khối lượng của Al2O3:
mAl2O3 = n.M = 0,075.102 = 7,65 (g)
Vậy: nếu đốt cháy hết 4,05 g bột Al thì thu được 7,65 g Al2O3
c. + Số g Al cần đốt:
mAl = n.M = 0,15.27 = 1,05 (g)
+ Số lít O2 cần đốt:
VO2 = n.22,4 = 0,1125.22,4 = 2,52 (l)
Vậy: để thu được 25,5 g Al2O3 thì cần đốt cháy hết 1,05 g Al và dùng ít nhất 2,52 lít O2
Note: mình không biết làm vậy đúng không nên trước khi tham khảo bạn hãy kiểm tra lại trước nhé, rồi có gì bảo mình.
Đúng 0
Bình luận (0)
3. Đốt cháy hoàn toàn 5,4g nhôm. Tính : a. thể tích khí O2 (đktc) cần dùng ? b. số gam KMnO4 cần dùng để điều chế lượng khí O2 trên ?
PTHH: \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
\(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{O_2}=0,15\left(mol\right)\\n_{KMnO_4}=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{O_2}=0,15\cdot22,4=3,36\left(l\right)\\m_{KMnO_4}=0,3\cdot158=47,4\left(g\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
bài 4: đốt cháy hoàn toàn 5,4g nhôm. Tính :
a) thể tích O2(đktc) cần dùng ?
b) số gam kMnO4 cần dùng để điều chế lượng khí O2 trên
\(n_{Al}=\dfrac{5.4}{27}=0.2\left(mol\right)\)
\(4Al+3O_2\underrightarrow{^{^{t^0}}}2Al_2O_3\)
\(0.2..........0.15\)
\(V_{O_2}=0.15\cdot22.4=3.36\left(l\right)\)
\(2KMnO_4\underrightarrow{^{^{t^0}}}K_2MnO_4+MnO_2+O_2\)
\(0.3...............................................0.15\)
\(m_{KMnO_4}=0.3\cdot158=47.4\left(g\right)\)
Đúng 4
Bình luận (0)
Đốt cháy bột nhôm kim loại trong không khí thu được Al2O3 . Để thu được 25,5g Al2O3 thì cần đốt cháy hết bao nhiêu gam bột nhôm và cầb dùng ít nhất bao nhiêu lít oxi?
ở điều kiện thường hay điều kiện tiêu chuẩn đấy bn
Đúng 0
Bình luận (0)
n Al2O3=25,5/102=0,25(ml=ol)
4Al + 3O2 --to-> 2Al2O3
0,5 0,375 <--- 0,25
mAl=0,5.27=13,5(g)
VO2=22,4.0,375=8,4(l)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 5,4g nhôm. Tính :
a. Thể tích khí O2 (đktc) cần dùng ?
b. Số gam KMnO4 cần dùng để điều chế lượng khí O2 trên giả sử quá trình thu khí oxi bị hao hụt 10% ?
\(n_{Al}=\dfrac{5.4}{27}=0,2mol\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
0,2 0,15 0,1
a)\(V_{O_2}=0,15\cdot22,4=3,36l\)
b)\(n_{O_2}=0,15\cdot10\%=0,015mol\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,03 0,015
\(m_{KMnO_4}=0,03\cdot158=4,74g\)
Đúng 1
Bình luận (0)
1/ Đốt cháy 5,4g bột nhôm trong khí oxi, người ta thu được nhôm oxit (Al2O3). Hãy tính khối lượng nhôm oxit thu được
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
0,2 0,2
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(m_{Al_2O_3}=0,2.102=20,4\left(g\right)\)
Đúng 0
Bình luận (2)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ PTHH:4Al+3O_2\xrightarrow[]{}2Al_2O_3\\ n_{Al_2O_3}=\dfrac{0,2.2}{4}=0,1\left(mol\right)\\ m_{Al_2O_3}=0,1.102=10,2\left(g\right)\)
Đúng 0
Bình luận (3)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ 4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ n_{Al_2O_3}=\dfrac{0,2}{2}=0,1\left(mol\right)\\ m_{Al_2O_3}=102.0,1=10,2\left(g\right)\)
Đúng 3
Bình luận (0)