Tính pH của dung dịch axit HCOOH 0,1M. Biết hằng số axit của axit fomic là 10-3,75
H24
Những câu hỏi liên quan
Dung dịch có chứa CH3COOH 0,1M và CH3COONa 0,1M. Tính độ pH của dung dịch. Biết rằng hằng số axit của CH3COOH là Ka 10-4,76.
Đọc tiếp
Dung dịch có chứa CH3COOH 0,1M và CH3COONa 0,1M. Tính độ pH của dung dịch. Biết rằng hằng số axit của CH3COOH là Ka = 10-4,76.
Sửa đề bài Vì CH3COONa là chất điện li mạnh nên được viết trước để tạo môi trường cho cân bằng của chất điện li yếu phân li và cân bằng:
CH³COOH ⇔ CH³COO -+H+
Ban đầu 0,1 0. 0
Phân li xM x. x
Cân bằng 0,1-x 0,1+x x
Suy ra K = \(\dfrac{x(x+0,1)}{0,1-x}\) = 1,8.10 mũ âm ⁵
⇒ x = 1,8 . 10 mũ âm ⁵
⇒pH = log x = 1745
Đúng 0
Bình luận (0)
Trộn 100ml dung dịch axit yếu HA 0,1M (Ka=10^-3,75) với 100ml dung dich NaOH 0,05M thu được dung dịch B. Tính pH của dung dịch B
HD:
HA: 0,01 mol; NaOH: 0,005 mol.
Dung dịch B dư HA 0,005 mol.
HA \(\Leftrightarrow\) H+ + A-
bđ: 0,005 0 0
cb: 0,005-x x x
Ka = x2/(0,005-x) = 10-3,75.
Giải phương trình thu được x = 8,58.10-4 = [H+]. Do đó: pH = -log[H+] = 3,066.
Đúng 0
Bình luận (0)
Dung dịch axit fomic 0,007M có pH = 3. Kết luận nào sau đây không đúng?
A.Khi pha loãng 10 lần dung dịch trên thì thu được dung dịch có pH = 4.
B.Khi pha loãng dung dịch trên thì độ điện li của axit fomic tăng.
C.Độ điện li của axit fomic trong dung dịch trên là 14,29%.
D.Độ điện li của axit fomic sẽ giảm khi thêm dung dịch HCl.
Trước khi pha loãng: pH = 3 → [H+] = 10-3 → nH+ = 10-3V1 (mol).
Sau khi pha loãng: nH+ = 10-pHV2 (mol) = 10-pH .10V1 (mol)
Do số mol sau pha loãng > trước pha loãng nên: pH < 4
Đúng 0
Bình luận (0)
cho dung dịch axit HNO2 0,1M, biết rằng hằng số phân li của axit Ka = 5.10-4. nồng độ mol/l của ion H+ là:
HNO2→H+ + NO2-
ban đầu 0,1..........0...........0
phân li x............x............x
cân bằng 0,1-x......x............x
\(Ka=\dfrac{\left[H^+\right]\left[NO_2^-\right]}{\left[HNO_2\right]}\\ 5.10^{-4}=\dfrac{x^2}{0,1-x}\)
\(\Rightarrow\left[H^+\right]=x=....\)
Em có thể tham khảo lí thuyết vào bài tập thêm trong chủ đề này
https://hoc24.vn/ly-thuyet/gia-tri-ph-cua-cac-dung-dich-axit-bazo.4749/
Đúng 0
Bình luận (0)
Dung dịch axit fomic 0,092% có khối lượng riêng xấp xỉ 1 g/ml. Trong dịch đó, chỉ có 5,0% số phân tử axit fomic phân li thành ion.
Hãy tính pH của dung dịch đó.
Khối lượng của 1 lít (1000 ml) dung dịch axit fomic 0,092% là 1000 g. trong đó khối lượng của axit fomic là:
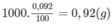
và số mol axit fomic là : 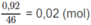
Số mol axit fomic phân li thành ion là:
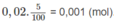
HCOOH ↔ H C O O - + H +
0,001 mol 0,001 mol
Nồng độ [ H + ] = 0,001 mol/l = 1. 10 - 3 mol/l. Vậy pH = 3.
Đúng 0
Bình luận (0)
Tính pH của dung dịch axit CH3COOH 0,1M sau khi đã cho thêm CH3COONa đến nồng độ 0,08M. Biết hằng số phân li của axit này là 1,8.10-5
Gọi x là nồng độ CH3COOH phân li.
\(\begin{matrix}CH_3COONa&\rightarrow&CH_3COO^-+&Na^+&\\0,08&&0,08&0,08&\left(M\right)\\CH_3COOH&\rightarrow&CH_3COO^-&+H^+&k_a=1,8.10^{-5}\\\begin{matrix}BD&0,1\end{matrix}&&0,08&&\\\begin{matrix}PU&x\end{matrix}&&x&x&\left(M\right)\\\begin{matrix}CB&0,1-x\end{matrix}&&0,08+x&x&\end{matrix}\)
\(k_a=\dfrac{\left[CH_3COO^-\right]\left[H^+\right]}{\left[CH_3COOH\right]}=\dfrac{\left(0,08+x\right)\left(x\right)}{\left(0,1-x\right)}=1,8.10^{-5}\)
\(x\approx2,24886.10^{-5}\)\(\Rightarrow pH=-log\left(\left[H^+\right]\right)=-log\left(x\right)=-log\left(2,24886.10^{-5}\right)\approx4,46804\)
Đúng 0
Bình luận (1)
Cho 0.03 mol axit HCl vào 1 L của dung dịch đệm
có nồng độ 0,6 M CH3COOH and 0,6M
CH3COONa. Tính pH của dung dịch. Biết hằng số
phân li của axit CH3COOH là: 1,8x10-5 ở 25oC
$CH_3COONa + HCl \to CH_3COOH + NaCl$
$n_{CH_3COOH} = 0,6.1 + 0,03 = 0,63(mol)$
$[H^+] = 0,63.1,8.10^{-5} = 1,134.10^{-5}M$
$pH = -log([H^+]) = -log(1,134.10^{-5}) = 4,945$
Đúng 3
Bình luận (1)
Có 5 dung dịch không màu:
H
O
O
C
-
C
H
2
-
C
H
2
-
C
H
N
H
2
-
C
O
O
H
(axit glutamic), NaI (natri iođua), HCOOH (axit fomic),
N
H
2
-
C
H
2
-
C
O
O
H
(...
Đọc tiếp
Có 5 dung dịch không màu: H O O C - C H 2 - C H 2 - C H N H 2 - C O O H (axit glutamic), NaI (natri iođua), HCOOH (axit fomic), N H 2 - C H 2 - C O O H (glyxin), N H 2 - C H 2 4 - C H N H 2 - C O O H (L-lysin). Cặp thuốc thử để nhận biết được cả 5 chất trên là:
A. Quỳ tím và dung dịch C u S O 4
B. Quỳ tím và dung dịch A g N O 3 / N H 3 3
C. Dung dịch HCl và dung dịch A g N O 3 / N H 3
D. Dung dịch NaOH và N a N O 2 / H C l
Đáp án B
- Đầu tiên cho quỳ tím vào:
+ axit glutamic, HCOOH: màu đỏ
+ glyxin, NaI: không đổi màu.
+ Lysin: màu xanh → nên nhận biết được lysin.
- Cho tiếp A g N O 3 / N H 3 vào 2 nhóm chưa nhận được:
+ Nhóm axit: có kết tủa là HCOOH, còn lại là axit glutamic.
+ Nhóm không làm quỳ đổi màu: Có kết tủa vàng đậm là NaI (kết tủa AgI màu vàng); còn lại là glyxin
Đúng 0
Bình luận (0)
Các dung dịch axit đều có nồng độ 0,01M : axit fomic (1); axit propionic (2); axit oxalic (3). Giá trị pH của các dung dịch giảm theo thứ tự A. (1), (2), (3). B. (2), (1), (3). C. (3), (2), (1). D. (3), (1), (2).
Đọc tiếp
Các dung dịch axit đều có nồng độ 0,01M : axit fomic (1); axit propionic (2); axit oxalic (3). Giá trị pH của các dung dịch giảm theo thứ tự
A. (1), (2), (3).
B. (2), (1), (3).
C. (3), (2), (1).
D. (3), (1), (2).


